La storia dei trapianti
Dalle narrazioni mitologiche, leggendarie e religiose ai primi resoconti sperimentali
articolo di Sergio Barocci – Università di Genova per la terza età e divulgatore scientifico
salute o giovinezza attraverso il trapianto

L’idea della possibilità di ridare salute o giovinezza attraverso il trapianto di parti del corpo da un individuo ad un altro ha sempre affascinato l’umanità fin dall’antichità, dando origine anche a narrazioni mitologiche, leggendarie e religiose.
Nella stessa mitologia egizia Anubi, figlio di Osiride viene raffigurato come un uomo dalla testa di sciacallo e poi la Sfinge figura mitologica che viene raffigurata come un mostro con il corpo di leone e testa umana mentre in quella cretese si parla del Minotauro come di una creatura terribile, mezzo uomo e mezzo toro, divoratore di uomini.
Non sono, neppure, da trascurare anche alcuni simbolismi religiosi.
SIMBOLISMI RELIGIOSI
La prima citazione di un prelievo d’organo si trova nell’Antico Testamento e, precisamente nella Genesi:
“mandò dunque il Signore Dio ad Adamo un sonno profondo e, essendosi egli addormentato, gli tolse una delle coste, e ne riempì il luogo con della carne. E con la costa che aveva tolta ad Adamo, formò il Signore Dio una donna, e gliela presentò…….”
Uno dei più antichi documenti proviene, invece, dalla mitologia induista del XII secolo a.C., dove si racconta di Ganesha (Signore della conoscenza), raffigurato con una testa di elefante provvista di una sola zanna. Accanto a queste narrazioni leggendarie vi sono però anche alcuni racconti di interventi scientificamente riproducibili.
UNA STORIA AFFASCINANTE
|
|
La storia dei trapianti è, quindi, una storia affascinante che parte da alcuni esperimenti realizzati nell’antichità per poi proseguire con i primi interventi chirurgici eseguiti nel Medioevo e nel Rinascimento fino al riconoscimento, alla fine del XIX secolo del trapianto come un vero e proprio atto medico grazie all’utilizzo di nuove procedure chirurgiche e antisettiche.
prima descrizione di un intervento di chirurgia ricostruttiva
La prima descrizione di un intervento di chirurgia ricostruttiva con tessuti autologhi si trova in uno dei testi classici della medicina Ayurvedica, il Sušruta Sanhita, un antico testo sanscrito datato intorno al VI secolo a.C., considerato tra i primi maggiori testi riguardanti lo studio dettagliato della Medicina e della Chirurgia, dove viene descritta una ricostruzione della piramide nasale, dopo amputazione traumatica con un lembo di cuoio capelluto e cute frontale, datato intorno al VI secolo a.C.
In testi risalenti a III sec. a.C. è invece descritto un trapianto di cuore eseguito dal medico cinese Pien Ch’iao; si narra che questo mitico chirurgo dell’epoca ricevette la visita di due malati che avevano sintomi opposti e trovò che l’equilibrio delle energie del corpo dei due uomini era turbato; per ristabilire l’equilibrio delle forze era necessario scambiare il centro dell’equilibrio fra i due uomini, cioè scambiare i loro cuori; i documenti riportano che i due pazienti guarirono.
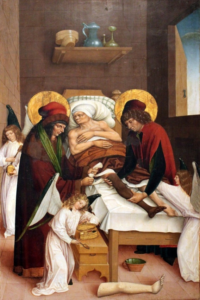
I santi Cosma e Damiano
|
|
Nel mondo Occidentale l’attestazione di un vero e proprio trapianto, sia pure in ambito miracolistico, è rinvenibile nella Legenda Aurea. Si tratta di una monumentale raccolta di biografie agiografiche composta in latino da Jacopo da Varazze nel XIII secolo, dove si narra che, all’epoca dell’imperatore Diocleziano, i Santi Anargiri (dal greco antico Ανάργυροι, “senza argento” o “Santi non mercenari”) Cosma e Damiano compirono il miracolo di sostituire la gamba ormai in cancrena di un sacerdote di razza bianca con l’arto nero di un etiope deceduto il giorno prima.
Il miracolo del braccio ricomposto

Lo spirito con cui i santi Cosma e Damiano procedono a questo intervento, è duplice: lenire la sofferenza e ridare capacità alla deambulazione. Rimane, tuttavia, l’enigma: perché sostituire la gamba di un altro uomo di pelle diversa? Forse perché era più facile da riconoscere nelle rappresentazioni pittoriche? O forse, perché simboleggiava già il potere della tolleranza con la quale si può ricevere un organo estraneo così come è possibile ottenere un interscambio fra diversi gruppi etnici, anticipando una società multietnica?
Un’ altra scena iconografica suggestiva è rappresentata dal miracolo “del braccio ricomposto“, del 1468, di Antoniazzo Romano.
Si tratta del miracolo di S. Francesca Romana che riattacca il braccio sinistro al cavaliere, staccato di netto, presumibilmente, dopo uno scontro d’arme.
I primi esperimenti di trapianti di tessuti ossei e di pelle
|
|
|
A Cordova, intorno al 1000 d. C., nella Spagna musulmana, Abu al Qasim Klalaf ibn al-Abbas Al-Zaharawi (936-1013), conosciuto anche con il nome di Albucasis, grande maestro della chirurgia ispano-arabica, descriveva una tecnica chirurgica per la sostituzione di elementi dentali mancanti mediante trapianto di denti estratti.
È con il Rinascimento che diverse tecniche di medicina e chirurgia orientale fanno il loro ingresso in Europa: i fratelli siciliani Gustavo e Antonio Branca (pionieri della rinoplastica) che tra il ‘300 e il ‘400, utilizzarono lembi cutanei delle guance e della zona interna della bocca per la ricostruzione nasale. I fratelli Paolo e Pietro Vianeo (allievi dei fratelli Branca, considerati i fondatori della chirurgia estetica) tra il 1540 e il 1565 proposero, invece, una tecnica di ricostruzione del naso, basata sul principio dell’innesto.
IL TAGLIACOZZI
|
|
È del medico bolognese Gaspare Tagliacozzi (1545-1599) la descrizione dei primi resoconti sui trapianti di tessuti, ossa e pelle nel suo trattato “De curtorum chirurgia per insitionem libri duo” (due libri sulla chirurgia mediante innesto), pietra miliare nella storia della chirurgia mondiale.
Secondo il metodo descritto da G. Tagliacozzi il naso veniva ricostruito con la pelle prelevata dal braccio dopo aver fatto avvicinare il braccio stesso al volto ed averlo tenuto fissato per settimane con un tutore appositamente studiato. Egli affermò inoltre che in alcuni trapianti tessutali l’impedimento all’esecuzione di questi interventi su un’altra persona era dovuto alla specificità dell’individuo, ponendo il questo modo l’attenzione su ciò che si è rivelato uno dei maggiori problemi della medicina dei trapianti, ovvero la reazione di rigetto. La sua opera fu considerata eretica ed il suo cadavere venne sepolto in terra sconsacrata.
Job Hanszoon van Meekeren
Altro resoconto sui trapianti ossei è riconducibile al 1668, ad opera dell’’olandese Job Hanszoon van Meekeren (1611-1666) che curò un soldato ferito alla testa con un innesto di osso proveniente dal cranio di un cane.
Il soldato sopravvisse all’intervento ma, ricevuta la scomunica, chiese a van Meekeren la rimozione dell’innesto che si era però già completamente saldato (Haeseker, 1988).
I resoconti sperimentali di trapianto nei secoli XVIII e XIX
È in questo periodo che emergono i resoconti di esperimenti di trapianto che porteranno al riconoscimento di questo intervento come un vero e proprio atto medico.
Nel XVIII secolo, John Hunter, chirurgo scozzese autodidatta, praticò una serie di trapianti sperimentali senza collegamenti vascolari, ad esempio con denti e tendini.
Tuttavia, il suo maggiore contributo al progresso della trapiantologia derivò dagli studi che egli effettuò in campo veterinario sulle caratteristiche dei freemartin (femmine di bovino, intersessuali e sterili, nate come gemelle di un maschio), la cui rilevanza per la comprensione dei processi immunitari emergerà solo due secoli più tardi quando, nel 1916, Frank Rattray Lillie (27giugno 1870 – 5novembre 1947), riprendendo gli studi condotti centocinquant’anni prima da Hunter, osservò che quando le membrane fetali di embrioni di vitello maschio e femmina si uniscono nell’utero, si sviluppa una circolazione sanguigna comune e l’embrione femminile viene modificato in senso maschile, dando origine a una vitella sterile (freemartin).
INNESTI CUTANEI
|
|
Con il XIX secolo i trapianti cutanei diventarono un campo di sperimentazione della medicina dei trapianti che fece segnare una serie di successi grazie al contributo di Giuseppe Baronio (1759-1811), un naturalista italiano che riuscì ad effettuare alcuni trapianti autologhi cutanei sperimentali a partire da tessuti animali, descritti nel suo libro “Degli innesti” segnando cosi l’inizio di una nuova era per la chirurgia plastica con la dimostrazione che era possibile ottenere con successo il trasferimento di pelle nello stesso individuo.
un lavoro passato inosservato
Il lavoro svolto da Baronio passò inosservato per diversi anni sino a quando i trapianti di pelle diventarono di uso comune e ben documentati.
Il primo trapianto di pelle autologo ben documentato venne infatti eseguito dal chirurgo britannico Astley P. Cooper al Guy’s Hospital di Londra nel 1817, mentre dopo il 1850, ulteriori sviluppi ad opera dei chirurghi Jacques L. Reverdin, Fedor Krause e Carl Thiersch, resero questo trapianto una terapia affermata.
trapianto di cornea
|
|
|
Il secolo XIX fu anche quello dei primi tentativi di trapianto di cornea. L’irlandese Samuel Bigger fu il primo ad effettuarlo con successo su un cucciolo di gazzella. La prima volta che il dottor Bigger ebbe l’opportunità di provare questo esperimento avvenne nel 1835, in un periodo in cui era prigioniero presso una tribù nomade di arabi, a circa dodici o quattordici giorni di viaggio dal Cairo. L’oggetto dell’operazione era una gazzella da compagnia, che aveva perso un occhio a causa di un’infiammazione, e la capacità di vedere con l’altro, a causa di una ferita della cornea. La cornea fu prelevata da un altro animale della stessa specie, portato ferito, ma non del tutto morto; si verificò l’adesione, e dieci giorni dopo l’operazione l’animale diede segni inequivocabili della vista, mentre la parte superiore della cornea trapiantata rimaneva perfettamente trasparente.
Una nota a piè di pagina al suo articolo ‘An Inquiry into the Possibility of transplanting the Cornea‘, pubblicato sul Dublin Journal of Medical Science nel 1837 riporta laconicamente il suo successo.
Il riconoscimento del concetto di trapianto e le prime innovazioni chirurgiche nel XX secolo
E’ solo nel XX secolo che la medicina dei trapianti d’organo iniziò progressivamente ad affermarsi in seguito ai miglioramenti chirurgici, all’emergere delle conoscenze immunologiche sui meccanismi del rigetto, alla scoperta di farmaci immunosoppressori, sino alla prospettiva della creazione di animali geneticamente modificati da cui attingere organi per trapianto nell’uomo.
Dall’epoca pionieristica degli inizi del XX secolo ai progressi in campo chirurgico, anestesiologico e immunologico del XXI secolo
Gli inizi del XX secolo: le prime innovazioni chirurgiche e la nascita del concetto del rigetto
|
|
|
È agli inizi del ‘900 che si assiste alla nascita di una medicina dei trapianti d’organo grazie alle innovazioni chirurgiche introdotte dallo svizzero Theodor Kocher, premio Nobel per la Medicina nel 1909; iniziò a farsi strada il concetto di sostituzione degli organi, dapprima negli animali quindi nell’uomo, mentre di pari passo prese corpo l’idea del rigetto come spiegazione teorica di una serie di fallimenti.
Questa sperimentazione determinò anche un’implementazione delle tecniche di narcosi e delle procedure antisettiche in ambito operatorio.
IL PRIMO TRAPIANTO SPERIMENTALE DI RENE

Particolarmente rilevanti furono gli sforzi chirurgici per realizzare il collegamento dei vasi sanguigni dell’organo trapiantato a quelli del paziente ricevente; questo problema fu affrontato dal chirurgo austriaco Emerich Ullmann, vero e proprio pioniere del trapianto renale che, nel 1902, praticò il primo trapianto di rene su un cane.
L’organo venne alloggiato nel collo dell’animale e l’arteria e le vene renali anastomizzate con l’arteria carotide e la vena giugulare. In seguito eseguì il medesimo intervento su un uomo affetto da uremia cronica.
Nonostante i problemi derivanti da potenziali sepsi fossero già stati affrontati con l’adozione come antisettico dell’acido fenico, proposto dal medico britannico Joseph Lister alla fine del XIX secolo, i trapianti sperimentali eseguiti da Carrel sugli animali e quelli tentati da Ullmann fallirono per la reazione da rigetto.
il tema della perfusione degli organi

Carrel affrontò inoltre, in collaborazione con l’aviatore Charles Lindberg (1902-1974) il tema della perfusione degli organi isolati e quindi privati del sangue ossigenato, per essere poi trasportati e trapiantati nelle migliori condizioni possibili.
Agli inizi del ‘900, il primo liquido di perfusione utilizzato fu una soluzione fredda, isotonica di Ringer lattato, costituita da destrano, soluzioni di plasma, bicarbonato e glucosio.
Nel 1969 entrò in uso la soluzione di Collins contenente fosfato e alte concentrazioni di glucosio e potassio, utilizzata su larga scala per molti anni, quindi modificata in Eurocollins, senza magnesio che tendeva a precipitare.
Nel 1988 venne approntata da Folkert O. Belzer, dell’Università del Wisconsin, una nuova soluzione di conservazione per organi da trapianto denominata soluzione di Belzer o UW solution.
LIQUIDI DI PERFUSIONE
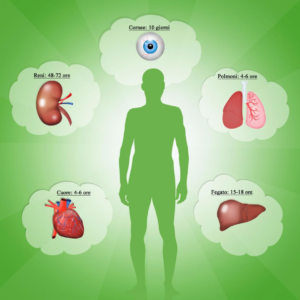
La grande novità di questa soluzione era rappresentata dalla presenza di gluconato (che previene il rigonfiamento cellulare), di glutatione (antiossidante) e di adenina e ribosio (precursori dell’ATP). Questa permise una migliore conservazione di organi come il fegato (fino a 12-15 ore rispetto alle 6-10 ore con la Eurocollins e alle 2 ore con la soluzione di Ringer lattato), il pancreas, l’intestino tenue, il cuore e i polmoni.
Alla fine degli anni ’90, per la perfusione e la conservazione in ipotermia del fegato, pancreas e rene, venne messa a punto la soluzione di Celsior, inizialmente proposta per il prelievo del cuore, in quanto garantiva una migliore attività antiossidante e tamponante per la presenza di nuovi sostanze quali il glutatione, l’istidina e il mannitolo e con una viscosità notevolmente inferiore che rendeva più omogenea la perfusione degli organi addominali.
il primo trapianto coronato da successo

Ritornando agli inizi del secolo XX, il primo trapianto coronato da successo nella storia della medicina fu il trapianto di cornea effettuato, nel 1905, dall’oftalmologo austriaco Eduard Zirm; la cornea di un ragazzo undicenne, morto per incidente ridiede la vista per tutta la vita ad un manovale reso cieco dalla calce viva. La procedura chirurgica sviluppata da Zirm è tuttora il metodo di base per trattare le lesioni della cornea.
Nel 1912, il patologo tedesco Georg Schöne (14novembre 1875 – 1febbraio 1960), nel suo trattato “Die Heteroplastische und Homoplastiche Transplantation”, avanzò l’ipotesi che la causa del rigetto del trapianto fosse da ascrivere ad un processo di natura immunologica: egli osservò che gli innesti di pelle provenienti dai membri della stessa famiglia sembravano sopravvivere più a lungo rispetto a quelli eseguiti in ambito non parentale.
DIVERSI TENTATIVI

Tra il 1907 e il 1925 furono poi effettuati vari tentativi di trapianto di cartilagine e di articolazioni da parte del chirurgo Erich Lexer (22maggio 1867 – 4dicembre 1937) ma tutti ebbero esito negativo.
Dal 1920 al 1950, i primi tentativi di trapianto renale furono coronati da insuccessi anche se tecnicamente riusciti. Il primo trapianto di rene sull’uomo fu eseguito nel 1933, il chirurgo ucraino Yuri Voronoy per primo collocò il rene nella coscia di un paziente affetto da uremia acuta per avvelenamento da bicloridrato di mercurio; il paziente sopravvisse 48 ore. Segnati da insuccesso furono altri sei trapianti renali da lui praticati nell’uomo fra il 1933 ed il 1939.
Negli anni ’40 il chirurgo vascolare Charles Hufnagel e l’urologo Ernest Landsteiner (1917-2007), entrambi attivi al Peter Bent Brigham Hospital di Boston, trapiantarono un rene da cadavere ad una donna divenuta uremica in seguito a sepsi collegando l’organo ai vasi del suo braccio. Il rene trapiantato funzionò e fu rimosso dopo tre giorni con la ripresa funzionale del rene nativo.
trapianto di rene

Nel 1950 Richard Lawler (1895-1982) eseguì, in un paziente affetto da rene policistico, un trapianto di rene collocando l’organo in sede retroperitoneale ed in posizione ortotopica, ma l’intervento fu seguito da insuccesso.
La sede retroperitoneale fu successivamente rivisitata dal chirurgo francese Renè Küss (1913-2006) che, nel 1951, descrisse la tecnica del trapianto di rene (Kuss, 1951) che con poche variazioni venne poi adottata da Joseph E. Murray (nel 1955) ed in seguito da chirurghi di tutto il mondo specializzati in questo tipo di trapianti.
Lo sviluppo del trapianto renale andò di pari passo con l’evoluzione delle apparecchiature per dialisi, i cui prototipi funzionanti furono approntati indipendentemente da Nils Alwall (in Svezia) e Willem Johan Kolff (in Olanda) durante la seconda guerra mondiale.
|
|
|
L’utilizzo di apparecchiature per la dialisi consentì, nel 1951, al chirurgo statunitense David Hume (1917-1973) di eseguire una serie di trapianti di rene da donatore cadavere collocati in sede inguino-femorale del ricevente; tuttavia, i risultati per il timore di essere aspramente criticato, non furono mai presentati al alcun congresso.
La medicina dei trapianti dagli anni ‘50 e la scoperta del sistema maggiore di istocompatibilità HLA nell’uomo

Parallelamente alla messa a punto di nuove metodiche chirurgiche, si assistette tra gli anni ‘40 e ‘60, all’affermarsi di nuove conoscenze sulla natura immunologica del rigetto e allo sviluppo di terapie farmacologiche atte a contrastarlo.
Karl Landsteiner aveva già scoperto nel 1900 il sistema AB0 dei gruppi sanguigni, dimostrando l’importanza della compatibilità fra donatore e ricevente nelle trasfusioni di sangue, fornendo così un importante stimolo a successive ricerche da parte di Alexander Solomon Wiener (16marzo 1907 – 6novembre 1976) che, nel 1940, scoprì il fattore Rh.
Nel 1937 l’immunologo inglese Peter Gorer (1907-1961) e il genetista George D. Snell (1903-1996) dimostrarono, utilizzando ceppi di topi congenici (ceppi di animali identici per genotipo, tranne che per un singolo locus genetico differente), che i geni dell’istocompatibilità H-2 nel topo controllavano gli antigeni tessutali riconosciuti nel rigetto, fondamentali per l’attecchimento del trapianto di cute.
conoscenze fondamentali sul sistema immunitario umano
|
|
|
Verso la metà degli anni ‘40 si cominciarono ad acquisire conoscenze fondamentali sul sistema immunitario umano e sulla reazione di rigetto, grazie alle ricerche del biologo britannico Peter Medawar che dimostrò sperimentalmente la natura immunologica del rigetto per le proprietà di specificità e memoria che lo caratterizzavano, prima attraverso esperimenti sui topi, poi sugli esiti di innesti cutanei in pazienti rimasti ustionati in occasione dei bombardamenti di Londra; Medawar fu insignito del Premio Nobel nel 1960.
concetto di compatibilità biologica

Questi esperimenti permisero di definire il concetto di “compatibilità biologica” tra individui diversi della stessa famiglia e dimostrarono anche che un secondo innesto di pelle proveniente dallo stesso donatore veniva rigettato dal medesimo ricevente più rapidamente rispetto al primo.
Gli studi di inizio secolo sui freemartin (femmina di bovino intersessuale e sterile, nata come gemello di un maschio) tornarono alla ribalta grazie al lavoro di Ray David Owen (30ottobre 1915 – 21settembre 2014).
Agli inizi degli anni ‘50, il gruppo di lavoro di Medawar ottenne due importanti risultati: l’assenza di rigetto in un trapianto di pelle fra una freemartin e il suo gemello maschio e, nei topi, l’acquisizione di uno stato di immunotolleranza con assenza di rigetto in innesti di cute nell’animale ricevente a cui erano state infuse cellule staminali del futuro animale donatore, prima però che intervenisse il riconoscimento ontogenico in grado di differenziare il self dal non-self (feto o animale appena nato).
scoperta del sistema mhc

Negli anni ‘60 l’immunologo francese Jean Dausset (premio Nobel nel 1980) scoprì il sistema MHC o HLA nell’uomo, fondamentale per la caratterizzazione delle proprietà tessutali della coppia donatore/ricevente ai fini di una migliore sopravvivenza del trapianto.
La maggior comprensione della reazione di rigetto permise anche di valutare le probabilità di successo di un trapianto, di identificare le caratteristiche del rigetto, di riconoscere la “graft versus host disease” (GvHD) nei trapianti di cellule staminali e di tentare di indurre una tolleranza verso l’organo trapiantato riducendo l’intensità della reazione immunologica.
Sempre in quegli anni venne sviluppato il trapianto di midollo osseo, dimostrando come l’infusione di cellule midollari fosse in grado di salvare topi e cavie irradiati in maniera letale.
TRAPIANTO DI MIDOLLO OSSEO

Nel 1957 Edward Donnall Thomas, al Mary Imogene Bassett Hospital di Cooperstown di New York, raccogliendo alcuni dati pubblicati in precedenza, perfezionò questo approccio, dapprima nei cani e poi, negli anni ‘70, in giovani affetti da leucemia avanzata al Fred Hutchinson Cancer Research Center di Seattle, dimostrando che le cellule del midollo osseo (staminali), infuse per via endovenosa, potevano ripopolare il midollo e produrre nuove cellule sane. Grazie a questi suoi studi, nel 1990, fu insignito del Premio Nobel per la Medicina insieme al J. Murray.
Oggi, le operazioni di trapianto di midollo osseo vengono praticate in maniera efficace e rappresentano una terapia consolidata per il trattamento di alcune malattie ematologiche, autoimmuni e genetiche attraverso l’utilizzo di cellule staminali ematopoietiche sia allogeniche che autologhe.
PRIMI TRAPIANTI RENALI
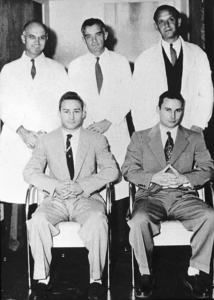
Il 23dicembre 1954, al Peter Pickle Bent Brigham Hospital di Boston, il chirurgo statunitense Joseph Murray (premio Nobel nel 1990) portò a termine con successo il primo trapianto renale senza immunosoppressione tra gemelli omozigoti, alloggiando per la prima volta, l’organo nella fossa iliaca. La sopravvivenza dell’organo trapiantato fu di ben otto anni, un periodo di tempo impressionante per quei tempi considerando che ancora non veniva praticata l’immunosoppressione. L’ipotesi del trapianto da vivente era stata presa in considerazione dopo aver testato la perfetta compatibilità genetica con il gemello attraverso un innesto incrociato di pelle.
Nel 1960 a Parigi, fu eseguito invece, il primo trapianto renale da parte di un donatore non imparentato.
In quel periodo furono sviluppati anche i primi metodi per sopprimere la reazione di rigetto utilizzando sia la “total body irradiation” con raggi X che la somministrazione di farmaci immunodepressivi.
IMMUNOSOPRESSIONE

Si cominciarono così ad ottenere risultati soddisfacenti soprattutto mediante l’utilizzo di una terapia immunodepressiva costituita dalla somministrazione associata di “azatioprina”, un antimetabolita sintetizzato nei laboratori della Burroughs Wellcome e di “corticosteroidi” (prednisone, prednisolone).
Tali metodi, pur presentando forti effetti collaterali, si rivelarono positivi per il successo dei trapianti.
Gli spettacolari successi trapiantologici negli anni ‘60

Gli anni ‘60 rappresentarono gli anni dell’inizio dell’era moderna per i trapianti: lo sviluppo delle tecniche di tipizzazione tissutale HLA, l’evoluzione del trattamento dialitico cronico e l’adozione della terapia immunodepressiva ne costituirono i cardini fondamentali.
Nel 1963 il chirurgo statunitense Thomas Starzl, definito il padre della trapiantologia moderna, praticò il primo trapianto di fegato sull’uomo a Denver nello stato del Colorado.
Nello stesso anno un altro chirurgo statunitense, James Hardy trapiantò un lobo di polmone a Jackson, nello stato del Mississippi, ma il paziente sopravvisse solo pochi giorni.
Nel frattempo, il trapianto di rene divenne gradualmente un intervento di routine, tanto che nel 1965 il registro dei trapianti di rene di Boston attestava in tutto il mondo 672 trapianti di rene effettuati da uomo a uomo.
TRAPIANTO DI PANCREAS E CUORE
Sempre alla fine degli anni’60 il trapianto si estese anche ad altri organi; è del 1966 il trapianto di pancreas ad opera di Richard Carlton Lillehei a Minneapolis nello stato del Minnesota.
Nel Dicembre del 1967 fece enorme scalpore in tutto il mondo la notizia del primo trapianto di cuore effettuato da Christiaan Barnard nella Clinica Groote-Schuur di Città del Capo in Sudafrica: egli trapiantò il cuore di una donna di colore nel petto di un uomo bianco (si rammenti l’arto trapiantato da Cosma e Damiano), ma non essendo ancora stato definito il concetto di “morte cerebrale” dovette attendere che il cuore della donatrice cessasse di battere prima di iniziare il trapianto: il cuore ripartì e il paziente sopravvisse per altri 18 giorni.
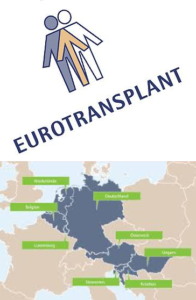
organizzazioni internazionali per lo scambio di organi

Tra il 1967 e il 1969 nacque la prima organizzazione internazionale per lo scambio di organi (Eurotransplant) grazie all’immunologo olandese Johannes Joseph van Rood (1926 – 2017), mentre risale al 1968 la prima legge unitaria sul trapianto di organi negli USA; sempre negli USA, Norman Shumway (1923-2006) eseguiva il primo trapianto di cuore.
Nel 1979, John A. Hansen (1943 – 31luglio 2019) del Fred Hutchinson Cancer Research Center, rese possibile il primo trapianto di midollo in un paziente leucemico con il midollo osseo di un donatore non consanguineo e, nel 1986, rese operativo il primo registro nazionale dei donatori di midollo osseo (NMDP), a cui seguirono molti altri Registri Nazionali di donatori volontari in tutto il mondo che si organizzarono in un network internazionale (BMWD), seguito da Banche di Cordone Ombelicale.
registri di donatori
|
|
Questo grande sforzo organizzativo e finanziario fu la premessa per la salvezza di migliaia di pazienti. I suoi contributi nel campo dell’immunologia dei trapianti comprendono la dimostrazione di come le variazioni genetiche del sistema immunitario contribuiscono al successo o al fallimento del trapianto di midollo. Definì le regole della compatibilità fra donatore e ricevente per il superamento della GvHD, il vero grande ostacolo alla riuscita di ogni trapianto.
ORGANI ARTIFICIALI

Agli anni ‘60 risalgono anche i primi tentativi di produzione di organi artificiali ma è solo nel 1982 che si assistette all’impianto di un cuore artificiale da parte di William de Vries a Salt Lake City, Utah, U.S.A., e in Italia, nel 1987, a Pavia da parte del cardiochirurgo Mario Viganò (23novembre 1938 – ).
Questi rimpiazzi artificiali, soggetti a costante miglioramento, sono oggigiorno utilizzati per supportare temporaneamente il cuore malato in attesa del trapianto.
In questo periodo si assistette inoltre alla sperimentazione di xenotrapianti, specialmente di rene, da scimpanzé a uomo e trapianti cardiaci, renali ed epatici da babbuino a uomo.
XENOTRAPIANTI
I risultati non furono incoraggianti e le sperimentazioni chirurgiche temporaneamente abbandonate per l’avvento dell’emodialisi, per la maggior disponibilità di organi, per la scoperta di anticorpi naturali contro antigeni eterofili e per l’impiego della ciclosporina come farmaco immunosoppressore.
Tale ricerca non fu però abbandonata, in quanto studi di ingegnerizzazione di animali, in particolare di maiali, portarono alla comprensione della causa dei fallimenti degli xenotrapianti che era imputabile ad una reazione di rigetto da parte di anticorpi preformati. Questi anticorpi riconoscevano strutture molecolari rappresentate da residui carboidratici prodotti da un enzima (alfa -1,3 galattosil-transferasi codificato da un solo gene), sull’endotelio vascolare del maiale.
studi di ingegnerizzazione di animali

Si trattava di una reazione immunologica che si manifestava nell’arco di pochi minuti (rigetto iperacuto), mediata dal sistema complementare.
Questa scoperta portò allo sviluppo di metodi sperimentali per la creazione di animali transgenici, in modo da prevenire il rigetto iperacuto attraverso l’eliminazione o l’inibizione degli anticorpi e del complemento del ricevente.
Nonostante questi notevoli progressi, rimangono ancora aperti alcuni problemi riguardanti la funzionalità degli organi del maiale; se siano o meno capaci di adempiere a tutte le necessità proteiche ed ormonali proprie dei tessuti umani e quelle dei rischi di infezione legati a questa pratica cioè alla possibilità che virus che hanno infettato l’animale possano essere trasmessi all’uomo.
Gli anni ‘70: la scoperta della ciclosporina e di altri farmaci immunosoppressori
Nonostante i successi ottenuti in chirurgia, il rigetto degli organi trapiantati continuava a rimanere un serio problema.
Agli inizi degli anni ‘70 in Svizzera, a Basilea, Jean F. Borel che lavorava presso i Laboratori della Sandoz, scoprì le proprietà anti-rigetto di una sostanza estratta da un fungo, la “ciclosporina”, un polipeptide ciclico ad azione immunosoppressiva in grado di bloccare i meccanismi che attivano le risposte immunitarie mediate da linfociti T.
una nuova fase nella storia della medicina dei trapianti
Questo scoperta diede inizio a una nuova fase nella storia della medicina dei trapianti.
Negli anni ‘80 la ciclosporina ricevette l’omologazione definitiva per il suo commercio ed il suo utilizzo portò la sopravvivenza dei soggetti trapiantati dal 20 al 70%. Questo rappresentò un vero e proprio spartiacque tra l’epoca pre e post ciclosporina.
Nel 1991, in alternativa alla ciclosporina si cominciò ad utilizzare come farmaco anti-rigetto anche il Tacrolimus (Prograf).
prevenire il rigetto

Le nuove conoscenze sulla complessità del sistema immunitario e degli eventi che costituivano il rigetto, permisero un continuo miglioramento nel controllo di quest’ultimo sia a livello molecolare che cellulare grazie all’introduzione di altri nuovi farmaci immunosoppressivi entrati a far parte di quel bagaglio farmacologico, utile a prevenire il rigetto come:
• gli inibitori della sintesi de novo delle purine (Micofenolato Mofetil o Cell Cept, Micofenolato sodico o Myfortic, Mizorbine o Bredinin);
• gli inibitori della proteina mTOR (una proteina chinasi a serina e treonina che regola la crescita e la proliferazione cellulare) come il sirolimus o rapamicina e l’everolimus;
• gli anticorpi policlonali anti-timociti o ATG;
• gli anticorpi monoclonali anti-interleuchina-2 (basiliximab, daclizumab).
INTERVENTI COLLADAUTI
Lo sviluppo di farmaci anti-rigetto, unitamente alla creazione di Istituzioni nate per l’attribuzione e la conservazione di organi, hanno di fatto consentito ai trapianti non solo di rene, di tessuti e di cellule ma anche di fegato, pancreas, cuore, polmone, intestino, visceri addominali multipli e recentemente di mano e di faccia, di entrare nel novero di interventi collaudati.
Nei Paesi in cui la medicina dei trapianti ha raggiunto elevati standard qualitativi, vengono costantemente rilevati i dati sul numero di donazioni di organi (da cadavere e da vivente), di trapianti effettuati e i successi ottenuti.
Le sfide prossime per gli anni a venire
La grande sfida per il futuro è quella di migliorare i risultati a lungo termine del trapianto di organi solidi. Oggigiorno, circa il 40% degli organi trapiantati viene perso entro 10 anni e un’alta percentuale di pazienti soffre di effetti collaterali.
Per risolvere questi problemi la medicina dei trapianti si sta orientando verso queste strategie:
• impiego della tecnologia di gene-editing CRISPR/Cas9 che potrebbe permettere una modifica dei geni tanto da poter potenzialmente rivoluzionare l’immunologia dei trapianti non solo per superare le barriere nell’ambito dello xenotrapianto, ma anche per le molte patologie a componente genetica;
• migliore identificazione dei pazienti a rischio di perdita del trapianto attraverso lo studio di nuovi biomarcatori affidabili, capaci di prevedere il fallimento del trapianto su lungo periodo e una maggiore comprensione dei processi immunitari sottostanti. Questi studi, potranno consentire lo sviluppo di terapie immunosoppressive su misura per ciascun paziente;
• prevenzione e trattamento del danno ischemico da riperfusione (IRI) in relazione al ruolo del sistema immunitario con lo sviluppo di approcci e agenti innovativi tramite nano particelle;
• trattamento dei pazienti con diabete di tipo 1 con cellule staminali embrionali e con cellule staminali pluripotenti indotte (iPSc) generate dalle cellule beta;
• applicazione su scala più ampia della terapia cellulare con le cellule T regolatorie (Treg) (una sottoclasse di cellule T che gioca un ruolo di primo piano nell’induzione e mantenimento della tolleranza immunologica e oggi, quelle maggiormente caratterizzate sono le cellule FOXP3+Tregs) per indurre uno stato di tolleranza verso cellule o organi non self allo scopo di prevenire e curare il rigetto anticorpo-mediato;
• trapianti di pelle e cornee ingegnerizzate, protesi robotiche comandate col pensiero;
• doppio trapianto di faccia
ERA BIOARTIFICIALE
Inoltre, è già cominciata l’era bioartificiale, dove il corpo umano si fonde sempre più con l’hitech per aprire le porte ad una medicina rigenerativa personalizzata; un fronte d’avanguardia per la bioingegneria, insieme ai robot per la chirurgia e alle nanotecnologie per la diagnostica e la terapia.
A cambiare il mondo della salute saranno gli organi artificiali, la robotica per la chirurgia a distanza, la riabilitazione e le protesi, ed infine, i sensori per la diagnostica. Sono questi i passaggi chiave di un continuo progresso scientifico che dovrebbe consentire di raggiungere nei prossimi anni un miglioramento degli esiti del trapianto su lungo periodo.
Bibliografia essenziale:
- Anderson, D., Billingham, R.E., Lampkin, G.H. and Medawar, P.B. (1951) “The use of skin grafting to distinguish between monozygotic and dizygotic twins in cattle“. Heredity 5; 379 – 397.
- Androutsos G, Vladimiros L, Diamantis A. (2007). “John Hunter (1728-1793): founder of scientific surgery and precursor of oncology“. J BUON 12(3); 421- 427.
- Baan, C.C. (2016). “Basic Sciences in development: what changes will we see in transplantation in the next 5 years?” Transplantation Dec 100 (12); 2507 – 2511.
- Bach, F.H., Robson, S.C., Winkler, H., Ferran, C., Stuhlmeier, K.M., Wrighton, C.J., Hancock, W.W. (1995). “Barriers to xenotransplantation“. Nat. Med. Sep; 1(9); 869 – 873.
- Barnard C.N. (1967). “The operation. A human cardiac transplant: an interim report of a successful operation performed at Groote Schuur Hospital, Cape Town“. S. Afr. Med. J. 41(48); 1271 – 1274.
- Beatty PG, Hansen JA, Longton GM, Thomas ED, Sanders JE, Martin PJ, Bearman SI, Anasetti C, Petersdorf EW, Mickelson EM, et al. “Marrow transplantation from HLA-matched unrelated donors for treatment of hematologic malignancies.” Transplantation. 1991 Feb;51(2):443-7. doi: 10.1097/00007890-199102000-00034.
- Bhishagratna K.K. (1866). “The Sushruta Samità“, English Translation of the original Sanscrit Text, XI, Varanasi, India, The Chowhamba Sanskrit Seies Office
- Brink J.G. (2009). “The first human heart transplant and further advances in cardiac transplantation at Groote Schuur Hospital and the University of Cape Town“. Cardiovasc. J. Afr. Feb 20(1); 31–35.
- Belzer, F.O. and Southard, J.H. (1988). “Principles of solid-organ preservation by cold storage“. Transplantation Apr 45(4); 673 – 676.
- Billingham, R.E., Brent, L., Medawar, P.B. (1953). “Actively acquired tolerance of foreign cells“. Nature 172; 603 – 606.
- Billingham, R.E., Brent, L., Medawar, P.B. (1956). “Quantitative studies on tissue transplantation immunity. III. Actively acquired tolerance“. Phil. Trans. R. Soc. Lond. B 239; 357 – 414.
- Borel, J.F, Feurer, C., Gubler, H.U., Stähelin, H. (1976). “Biological effects of cyclosporin A: a new antilymphocytic agent“. Agents Actions 6 (4); 468 – 475.
- Carosella, E.D. (2009). “From MAC to HLA: Professor Jean Dausset, the pioneer“. Human Immunol. Sep 70 (9); 661 – 662.
- Chapman, L.E. (2003). “Xenotransplantation: public health risks–patient vs. society in an emerging field“. Curr. Top. Microbiol. Immunol. 278; 23 – 45.
- Choong, C,, Kaye, A.H. (2009). “Emil Theodor Kocher (1841-1917)“. J. Clin. Neurosci. Dec;16(12); 1552 – 1554.
- Commitee della Harvard Medical School (1968). “A definition of irreversible coma. Report of the Ad Hoc Committee of the Harvard Medical School to Examine the Definition of Brain Death“. JAMA Aug 5; 205(6); 337 – 340.
- Crawford, A.Z., Patel, D.V., McGhee, C.N.J. (2013). “A brief history of corneal transplantation: from ancient to modern“. Oman J. Ophthalmol. Sep 6 (Suppl 1); 12 – 17.
- De Vries, W.C., Anderson, J.L., Joyce, L.D., Anderson F.L., Hammond, E.H., Jarvik, R.K., Kolff, W.J. (1984). “Clinical Use of the Total Artificial Heart“. N. Engl. J. Med. February 2, 310 ; 273 -278.
- Doudna, J.A. and Charpentier, E. (2014). “Genome editing: The new frontier of genome engineering with CRISPR – Cas9“. Science Nov 28; 346.
- Druml, W. and Druml, C. (2004). “Emerich Ullmann (1861-1937): not only a pioneer of kidney transplantation“. J. Nephrol. May – Jun 17(3); 461 – 466.
- Fariña-Perez, L. A. (2009). “Jaques-Louis Reverdin (1842 – 1929): The Surgeon and the Needle” History of Urology. 4 (63); 272.
- Fazio B. (1745) “De Viribus Illustribus“, Firenze, Giovannetti, 1745.
- Fioravanti, L. (1570). “Il Tesoro della Vita Humana“, Venezia, Sessa, 1570.
- George A.J.T. , Larkin D.F.P. (2004). “Corneal transplantation: the forgotten graft“. Am J Transplant 4; 678 – 685
- Gibson, T., and Medawar, P.B. (1943). “The fate of skin homografts in man“. J. Anat. 1943 Jul; 77 (Pt 4); 299 – 310.
- Giles, L. (1912). “Taoist Teachings from the Book of Lieh-Tzŭ. Wisdom of the East“.
- Hardy J.D. (1999). “The first lung transplant in man (1963) and the first heart transplant in man (1964)“. Transplant Proc. Feb – Mar 31 (1 – 2); 25-29.
- Hoffenberg, R. (2001). “Christiaan Barnard: his first transplants and their impact on concepts of death“. BMJ Dec 22-29;323(7327); 1478 – 1480.
- Kelly, W.D., Lillehei, R.C., Merkel, F.K., et al. . (1967). “Allotransplantation of the pancreas and duodenum along with the kidney in diabetic nephropathy“. Surgery 61(6); 827 – 837
- Kuss, R., Teinturier, J., Milliez, P. (1951). “Quelques essais de greffe rein chez l’homme“. Mem Acad Chir. 77; 755.
- Leclerc L. (1861). “La chirurgie d’Abulcasis“, Ed. Araba e Traduzione Francese Paris 1861.
- Leonard, D.A., Kurtz, J.M., Mallard, C.. et al. (2014). “Vascularized composite allograft tolerance across MHC barriers in a large animal model“. Am. J. Transplant. Feb 14(2); 343 – 355.
- Markić, D., Valencić, M., Maricić, A., et al. (2012). “Kidney transplantation – a successful story started 110 years ago“. Acta Med. Croatica Oct 66 Suppl 2; 59 – 63.
- Martin C.E. (1970). “John Hunter and tissue transplantation“. Surg Gyn Obstet 131; 306 – 310.
- Mirskii, M.B. (2005) “The pioneer of clinical transplantology (to the 110th anniversary professor Yu. Yu. Voronoi)“. Klіn. Khіr.; (6); 60 – 64.
- Murray, J.E., Tilney, N.L., Wilson R.E. (1976). “Renal transplantation: a twenty-five year experience“. Ann Surg. Nov 184 (5); 565 – 573.
- Owen, R.D. (1945). “Immunogenetic consequences of vascular anastomoses between bovine twins“. Science Oct 19;102(2651); 400 – 401.
- Raikwar, S.P., KIM, E.M., Sivitz, W.I.et al. . (2015). “Human iPS cell-derived insulin producing cells form vascularized organoids under the kidney capsules of diabetic mice“. PLoS One Jan: 10(1).
- Schwokowski C.F. (1996) “In memory of Carl Thiersch–on the 100th anniversary of his death” Zentralbl Chir. 121(5); 426 – 429.
- Shklar G. (2008). “John Hunter as an oral pathologist“. J Hist Dent. Spring; 56(1); 31 – 34.
- Singal R, Singal RP, Mittal A, Sangwan S, Gupta N.(2011) “Sir Astley Paston Cooper: history, english surgeon and anatomist“. Indian J Surg. 73(1); 82 – 4.
- Starnes, V.A., Shumway, N.E. (1987). “Heart transplantation – Stanford experience“. Clin. Transpl.; 7 – 11.
- Starzl, T.E., Marchioro, T.L., Von Kaulla, K.N. et al. (1963). “Homotransplantation of the liver in humans“. Surg. Gynecol. Obstet. Dec 117; 659 – 676.
- Stead, S.O., McInnes, S.J.P., Kireta, S.et al. . (2018). “Manipulating human dendritic cell phenotype and function with targeted porous silicon nanoparticles“. Biomaterials 155; 92 – 102.
- Tagliacozzi G 1597. “De Curtorum cirugia per insitionum“. Bindonum, Venice, Italy
- Timio, M. (1981). “Lister fondatore della Chirurgia moderna“. Mario Timio, Brescia: La scuola.
- Urrutia, A., Duffy, D., Rouilly, V. et al. (2016). “Standardized Whole-Blood Transcriptional Profiling Enables the Deconvolution of Complex Induced Immune Responses“. Cell Rep. 16(10); 2777 – 2791.
- Vienken, J., Klinkmann, H., Rakhorst, G. (2009). Inventions can’t wait”: a tribute to Willem Johan Kolff. Int. J. Artif. Organs 32(4); 191 – 198.
- Viganò, M., Parenzan, L., Gallucci, V.et al. . (1989). “Heart transplant. Multicenter study in Bergamo, Padua, Pavia” November 1985-February 1987, Minerva Chir. 44(1 – 2); 55-58.
- Wittwer, T. , Wahlers, T., Cornelius, J.F.et al. . (1999). “Celsior solution for improvement of currently used clinical standards of lung preservation in an ex vivo rat model“. Eur. J. Cardiothorac. Surg. 15(5); 667 – 671.
- Yalamanchili H, Sclafani AP, Schaefer SD, Presti P.(2008) “The path of nasal reconstruction: from ancient India to the present“. Facial Plast Surg. Jan; 24(1); 3-10.
- Yell, M., Muth, B.L., Kaufman, D.B. et al. (2015). “C1q Binding Activity of De Novo Donor-specific HLA Antibodies in Renal Transplant Recipients With and Without Antibody-mediated Rejection“. Transplantation 99(6); 1151-1155.
- Zimmerman KW (1998). “One leg in the grave: The miracle of transplantation of the black leg by Saint Cosmos and Damian“. Elsevier, Maarssen, The Netherlands
Sitografia: