Le cellule CAR-T: Una cronistoria
- Articolo del prof. Sergio Barocci – Università di Genova per la terza età
Introduzione
L’utilizzo del sistema immunitario per il trattamento avanzato contro i tumori ha mostrato una notevole potenza negli ultimi anni e rappresentato uno degli approcci immunologici più promettenti con l’impiego delle cellule CAR-T (Chimeric Antigen Receptor T cell therapies).
Tuttavia, per arrivare a questa strategia di ultima generazione che si basa sull’ingegnerizzazione genetica dei linfociti T in maniera tale da potenziarli per combattere i tumori, occorre iniziare con la descrizione del Sistema Immunitario, una macchina complessa costituita da diversi elementi (cellule e molecole ) che devono interagire tra loro per proteggerci da patogeni esterni come i virus, batteri, miceti, protozoi e da cellule dannose come quelle tumorali che mettono a rischio la salute umana.
Sistema Immunitario
Il Sistema Immunitario lo possiamo immaginare come una specie di esercito che ci protegge efficacemente. Tra le sue fila ci sono i linfociti T, un tipo di globuli bianchi paragonabili ad un corpo di forze speciali e sono proprio queste cellule ad aver attirato l’attenzione dei ricercatori che in tutti questi anni li hanno studiati, isolati e modificati sino a farli diventare uno strumento nella lotta contro i tumori.
Ma come la storia delle scienze insegna, la creazione di terapie innovative non segue mai un percorso lineare e veloce. Occorre tempo, molto denaro, sperimentazioni, errori, tanta genialità ma anche diversa fortuna. Ma per scoprire come è iniziata questa avventura scientifica, occorre andare indietro nel tempo fino al XIX secolo.
TUMORI ED INFEZIONI

In quel periodo, gli scienziati avevano osservato che i tumori crescevano più lentamente se erano in corso alcuni tipi di infezione nell’organismo ma non esistendo allora gli antibiotici come cura, erano le stesse infezioni batteriche a causare la morte dei pazienti.
Alla fine del XIX secolo, il chirurgo e ricercatore statunitense William Coley (12gennaio 1862 – 16aprile 1936), considerato come il padre dell’immunoterapia, utilizzò dei preparati batterici uccisi dal calore come terapia delle malattie oncologiche. Egli si accorse che i soggetti affetti da tumore, colpiti da una infezione batterica del genere “Streptococchi”, potevano persino guarire; il Sistema Immunitario risvegliato dalla nuova infezione poteva diventare aggressivo da distruggere anche le cellule neoplastiche. Tuttavia, questi suoi tentativi di infettare volontariamente i malati di tumore non produssero risultati convincenti ma piuttosto ambigui. Un varco era stato aperto ma la strada era ancora lunga.
William ed Helen Coley

Il contributo di Coley rimase nell’ombra per molto tempo ma riemerse grazie agli sforzi della figlia Helen Coley, che nel 1953 fondò il “Cancer Research Institute” di New York. Helen ha trascorso diversi anni esaminando oltre 15.000 lettere di suo padre, raccogliendo informazioni su più di 1.000 pazienti affetti da cancro che erano stati curati con il suo approccio e su altri 450 pazienti affetti da cancro che avevano infezioni batteriche naturali. La sua conclusione fu che il trattamento, che è stato soprannominato Tossine batteriche miste di Coley, o in breve Tossine di Coley, aveva funzionato in molti casi. Sfortunatamente, ella scoprì che erano state utilizzate diverse formulazioni delle tossine, non tutte efficaci, il che portò a risultati incoerenti e spesso irriproducibili. Era ancora convinta che ci fosse qualcosa di valido nell’approccio di suo padre e trascorse anni cercando di convincere i leader nel campo del cancro a indagare ulteriormente sulla questione.
Ehrich e Macfarlane Burnet

Agli inizi del XX secolo Paul Ehrlich, immunologo tedesco e Premio Nobel per la Medicina nel 1908 aveva ipotizzato che alcune molecole dell’organismo fossero in grado di combattere i tumori. A Ehrlich va il merito di aver ideato la chemioterapia, nota oggi come la terapia standard per la cura dei tumori.
A distanza di circa 50 anni Frank Macfarlane Burnet (3settembre 1899 – 31agosto 1985), immunologo australiano e Premio Nobel per la Medicina nel 1960, suggerì che le stesse cellule tumorali fossero in grado di suscitare una risposta immunitaria, introducendo cosi il concetto di immunosorveglianza.
Il sistema immunitario, infatti, è in grado di individuare ed attaccare le cellule tumorali. I responsabili di questo meccanismo di difesa sono i linfociti T che riconoscono gli antigeni sulle cellule neoplastiche classificandole come nemiche e dirigendo, quindi, la risposta immunitaria contro di esse.
Ma cosa sono gli antigeni?

Gli antigeni sono delle molecole identificative esposte come delle antenne sulla superficie cellulare delle cellule neoplastiche, in modo da essere riconosciute dal sistema immunitario. Questa difesa dell’organismo non è però sempre efficace. Le cellule tumorali sono in grado di mettere in pratica una serie di strategie di fuga che le rendono invisibili ai linfociti T e, quando ciò accade, il tumore continua a proliferare con il rischio di originare delle metastasi.
Da qui, nasce l’idea alla base dell’immunoterapia, cioè individuare il modo con cui i linfociti T possono riconoscere, attaccare ed eliminare le cellule tumorali.
In poche parole, addestrare un corpo di forze molto speciali.
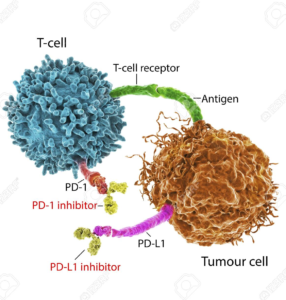
Tuttavia, per comprendere come sia nata l’immunoterapia oncologica mancava ancora un tassello: la scoperta dei cosiddetti checkpoint immunitari. Si tratta di particolari proteine presenti sulla superficie di diverse cellule del sistema immunitario che servono a regolarne l’attività, agendo come acceleratori off-free.
checkpoint immunitari
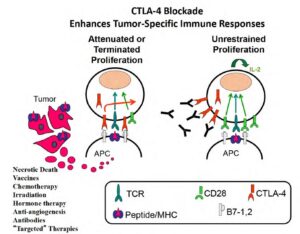
Il sistema immunitario è, infatti, finemente regolato per poter agire con modalità tempistiche corrette. L’acceleratore induce un attacco tempestivo contro i microorganismi estranei o contro le cellule dannose, come nel caso dei tumori, e il loro freno entra in gioco per evitare che si inneschi una eccessiva o prolungata attivazione che può portare alla distruzione autoimmune di cellule e tessuti sani.
Ma a loro volta le cellule tumorali sono in grado di sfruttare a loro vantaggio questo sistema di autoregolazione per sopravvivere e proliferare. Disinnescare i freni che impediscono al sistema immunitario di compiere un attacco efficace contro i tumori è stato l’obiettivo di ricerche pionieristiche condotte negli anni ’90 del secolo scorso.
Le proteina CTLA-4 e pd-1

Tra i ricercatori impegnati in questo ambito, c’è l’immunologo statunitense James Patrick Allison che, conducendo ricerche presso l’Università della California a Berkeley nel campo delle terapie immunologiche contro i tumori, individua il ruolo rivestito dalla proteina CTLA-4 (proteina 4 Associata ai Linfociti T Citotossici) nel bloccare la risposta immunitaria dei linfociti T contro autoantigeni, e riuscendo successivamente a sviluppare un anticorpo anti-CTLA-4 che determina l’attivazione delle cellule T, in grado di fornire una adeguata risposta antitumorale.
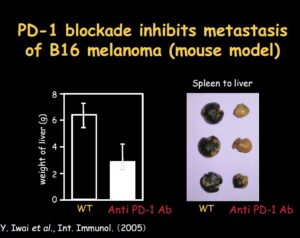
Contemporaneamente un altro immunologo, il giapponese Tasuku Honjo, presso l’Università di Kyoto, individua un’altra proteina chiamata PD-1 (Proteina 1 della morte cellulare programmata), un recettore che inibisce il riconoscimento delle cellule tumorali a opera delle cellule T, impedendo l’attivazione della risposta immunitaria. Entrambi, hanno ricevuto il Premio Nobel per la Medicina nel 2018 proprio per aver aperto le porte alla moderna immunoterapia oncologica grazie alle loro scoperte sull’inibizione della regolazione immunitaria negativa.
Le cellule CAR-T
In seguito i ricercatori si sono però accorti che manomettere il meccanismo di autoregolazione del sistema immunitario non è sempre sufficiente. Occorrevano nuove idee che arrivarono anche grazie all’avvento di tecniche sempre più avanzate di manipolazione del DNA.
L’obiettivo divenne quello di ingegnerizzare e potenziare le cellule immunitarie come i linfociti T. Sono nate così le cellule CAR-T.
Esse rappresentano una forma di terapia genica perché si basano sulla manipolazione genetica dei linfociti che vengono così equipaggiati con uno speciale recettore in grado di riconoscere le cellule tumorali.
Le terapie a base di cellule CAR-T
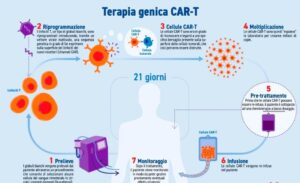
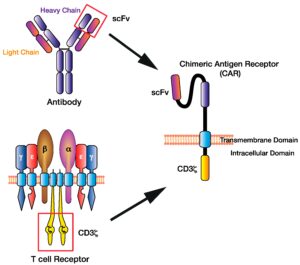
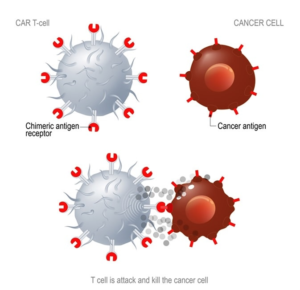
Le terapie a base di cellule CAR-T sono caratterizzate dall’espressione sulla superficie dei linfociti T di una particolare proteina chiamata Recettore Chimerico per l’Antigene, abbreviato CAR. Si tratta di una sorta di antenna molecolare in grado di legare gli specifici antigeni sulla superficie delle cellule tumorali in modo che i linfociti T acquistino la capacità di riconoscerli, attaccarli e distruggerli.
L’idea delle prime CAR-T si deve all’immunologo israeliano Zelig Eshhar, del Weizmann Institute of Science e del Tel Aviv Sourasky Medical Center che descrive nel 1989 l’impiego dei linfociti T geneticamente modificati in modo tale da esprimere un recettore simile all’anticorpo. Tuttavia, le sue CAR –T non erano ancora efficaci e non sopravvivevano a lungo nell’organismo.
ESHHAR E JUNE

Fu grazie a Carl H. June, immunologo statunitense che, nei primi anni duemila, si arrivò all’assemblaggio del primo CAR in grado di riconoscere l’antigene CD19 espresso sulle cellule dei tumori del sangue. Sino ad allora nessuno aveva trovato un modo per veicolare all’interno dei linfociti T le informazioni necessarie a produrre il recettore CAR. La motivazione di tale ricerca ebbe luogo quando seppe che alla moglie era stato diagnosticato un tumore ovarico mentre stava conducendo degli studi sul virus dell’HIV.
In seguito, C.H. June perfezionò il lavoro di Eshhar e riuscì a manipolare geneticamente i linfociti T ricorrendo proprio al virus HIV come vettore, oggi, utilizzato in diversi protocolli di terapia genica.
I linfociti T sono il bersaglio naturale dell’HIV. Quindi, June decise di utilizzare questo virus per portare all’interno delle cellule del sistema immunitario le istruzioni genetiche necessarie al loro potenziamento.
Il virus dell’HIV per potenziare i linfociti t

Una volta messa a punto la tecnica, nel 2010 fu avviato uno studio clinico per testare la terapia sperimentale su alcuni pazienti. Ad una bambina era stata diagnosticata una leucemia linfatica acuta ed era stato sottoposta a svariati cicli di terapia senza che la malattia si arrestasse.
Dopo che le venne praticata un’infusione di milioni di linfociti T modificati, la malattia andò finalmente in remissione. Si trattava di una guarigione completa che lasciò stupefatto lo stesso June, che mai avrebbe immaginato di ottenere un risultato così stupefacente.
I risultati traslazionali del dottor June hanno stimolato un nuovo settore per la terapia cellulare, evidenziato dall’alleanza stabilita nel 2012 tra la compagnia farmaceutica Novartis e l’Università della Pennsylvania. Il dottor June è stato insignito di numerosi riconoscimenti, tra cui il premio Paul Ehrlich.
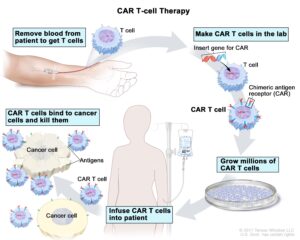
Cosa sono le cellule T del recettore dell’antigene chimerico (CAR -T) e come funzionano
In questo frangente, ci si muove nell’ambito della medicina personalizzata o medicina di precisione.
Le CAR-T sono delle innovative terapie costruite partendo dalle cellule del paziente che deve essere trattato.
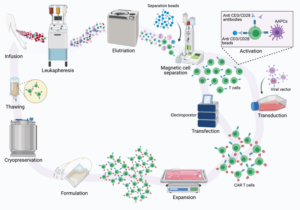
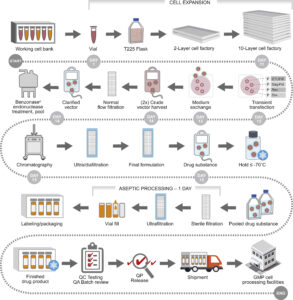
Il processo di prevenzione ha inizio con un prelievo di sangue; successivamente i leucociti vengono separati dagli altri elementi cellulari con un procedimento chiamato leucoaferesi.
Vengono, quindi, isolati i linfociti T, congelati e avviati alla Cell Factory ovvero siti specializzati in cui avviene il processo di manipolazione genetica. Tramite speciali vettori virali vengono introdotti nei linfociti T le informazioni genetiche utili a far esprimere il recettore CAR dando così origine alle cellule CAR-T.
Le Cell Factories
Nel giro di circa due settimane le Cell Factories producono le CAR-T da rispedire al centro clinico specializzato per l’infusione nel paziente. Tuttavia, prima della somministrazione, il paziente viene sottoposto a chemioterapia. Ciò permette ai linfociti T potenziali di espandersi e attivarsi nell’organismo.
Ritornando alla strategia terapeutica ideata da C. June, questa doveva essere ancora perfezionata perché nei diversi studi clinici che seguirono, alcuni pazienti andavano incontro a gravi effetti collaterali tra cui la sindrome da rilascio delle citochine, molecole secrete dalle cellule del sistema immunitario che modulano la risposta alle minacce e che in questo preciso caso innescano una risposta eccessiva e la neurotossicità che porta al danneggiamento cerebrale e del sistema nervoso periferico.
UNA STRADA ORMAI TRACCIATA
Ma la di là delle complicanze da risolvere, la strada per la innovativa terapia CAR-T era ormai tracciata. Dopo i primi studi clinici sugli adulti, nel 2012 è stata arruolata la prima paziente pediatrica per testare una terapia CAR-T sviluppata ancora dal gruppo di ricerca coordinato da C. June.
Si tratta di una bambina di 7 anni affetta da una forma di leucemia linfoblastica acuta, particolarmente resistente alle terapie standard. La paziente venne sottoposta a più cicli di chemioterapia, senza successo. Un’altra opzione terapeutica promettente era rappresentata dal trapianto di cellule staminali ma non percorribile per la giovane. Disperati, i genitori si rivolsero al Children Hospital di Philadelfia dove C. June stava coordinando lo studio clinico con le innovative cellule CAR-T. La bambina leucemica ricevette il trattamento sperimentale nella primavera del 2012 come ultima possibilità dopo gli insuccessi precedenti.
UNA COMPLETA GUARIGIONE DALLA LEUCEMIA
Dopo l’infusione delle cellule CAR-T, la bambina andò incontro alla sindrome da rilascio delle citochine con febbre alta e grave difficoltà respiratoria. Per risolvere questo problema le venne somministrato un anticorpo monoclonale sviluppato per trattare l’artrite reumatoide. Si rivelò la scelta giusta ed è così che la terapia a CAR-T le salvò la vita portandola ad una completa guarigione dalla leucemia. Nel 2022 la paziente ha festeggiato i dieci anni dalla guarigione ed oggi sta vivendo la sua vita senza più l’ombra della malattia.
Ciò che gli immunologi sognavano da decenni stava diventando realtà.
Cinque anni dopo il suo trattamento, nel 2017 l’Agenzia Regolatoria Statunitense (FDA) ha autorizzato l’emissione in commercio delle prime due terapie a base di cellule CAR-T per trattare alcune forme di leucemia e di linfomi.
Autorizzazione delle Terapia
Queste terapie sono sbarcate anche in Europa nel 2018 con il via da parte dell’Agenzia Europea dei medicinali. A settembre 2021 le CAR-T presenti sul mercato europeo hanno raggiunto la quota di quattro e di queste, due, sono disponibili anche in Italia.
I bersagli principali sono alcune forme di leucemia e linfomi recidivanti e resistenti alle terapie standard mentre l’ultima CAR-T che ha avuto il via europeo è rivolta contro il mieloma multiplo.
La manipolazione genetica del sistema immunitario come strumento di aggressione delle cellule tumorali rappresenta una delle pagine più straordinarie della medicina moderna.
problematiche da risolvere
Rimangono però importanti problematiche da risolvere. In primo luogo occorre considerare l’efficacia della terapia. Dai dati raccolti nel corso degli anni si sa che la remissione completa si verifica in un’alta percentuale di pazienti ma solo nel 30% dei casi si mantiene senza la necessità di un ulteriore intervento.
Non è tuttavia ancora noto perché in alcuni pazienti questo si verifica, e da questo punto di vista è importante la ricerca nel comprendere se questo tipo di peculiarità è legato al tipo di cellula o al tipo di caratteristiche nel CAR che è stato infuso.
Il secondo aspetto riguarda lo sviluppo e la produzione. Bisogna tener presente la complessità della gestione di un farmaco personalizzato: a) le cellule del paziente modificate e in questo senso si tratta di una situazione assolutamente innovativa e b) una rigida certificazione di qualità.
Lotta contro diverse forme di neoplasie
Sono diversi gli studi clinici nel mondo che contano sulle CAR-T per combattere le diverse forme di neoplasie. La maggior parte sono condotte in Cina e negli USA, ma anche in Europa e in Italia, dove si sta cercando di mettere a punto CAR-T più efficaci con processi di produzione ottimizzati e che mirano a nuovi bersagli.
Ad oggi, la patologia onco-ematologica come i linfomi e le leucemie continuano a rappresentare maggiormente il terreno di gioco ideale per le CAR-T.
Sta anche crescendo, oggi, l’attenzione per il settore dei tumori solidi e in questo caso ci si trova di fronte ad una delle sfide più complesse, poiché esistono delle problematiche legate alla scelta dell’antigene e alle difficoltà di accesso al microambiente tumorale.
STUDIANDO GLI ANTIGENI BERSAGLIO
La terapia a base di cellule CAR-T per sconfiggere i tumori solidi rappresenta una autentica rivoluzione per la Medicina consentendo di trattare un numero maggiore di malati in tutto il mondo. La scelta dell’antigene bersaglio per la preparazione delle CAR-T pone un quesito fondamentale. Sinora il successo delle terapie accreditate e autorizzate è basato prevalentemente sull’espressione di CAR diretti contro un antigene espresso sulla maggior parte delle neoplasie linfoidi, il CD19, ma a differenza delle neoplasie onco – ematologiche, nei tumori solidi ad esempio esiste una grande varietà di antigeni espressi sulla superficie e molti sono addirittura condivisi con le cellule sane.
Il problema dell’efficacia terapeutica
Analogo problema esiste in altri tipi di leucemie, come la leucemia mieloide, e la presenza dello stesso antigene sulle cellule sane pone il problema dell’efficacia ma in particolar modo la sicurezza di questi prodotti.
Ed è proprio per questi motivi che si stanno sviluppando in molti laboratori del mondo strategie diverse come quelle di avere CAR che sono costruiti per avere multiple funzioni: il riconoscimento dell’antigene tumorale da un lato ed un secondo più specifico per guidare l’assalto della cellula CAR o ancora per modulare eventuali segnali di freno che l’ambiente, dove la cellula tumorale alberga, possa ovviamente impedire la completa attività dei CAR.
nello specifico
Infine, un’altra grande linea di ricerca è legata, in questo momento, alla possibilità di esplorare che in alternativa all’utilizzo delle cellule del paziente, si possano adoperare cellule derivate da donatori che siano rese tali per più pazienti; cioè per una sorta di cellule CAR-T universali (UCAR-T) che siano basate su cellule che non diano una risposta allogenica dirigendo nel paziente oppure sulla manipolazione genetica di cellule eliminando quelle componenti che sono troppo importanti perché una cellula venga riconosciuta come estranea.
Naturalmente ciò richiede notevoli sforzi anche se non mancano già ora i successi e questo potrebbe allargare gli orizzonti nei tumori verso cui indirizzare questa straordinaria terapia.
Nello specifico, le cellule T vengono prelevate dal sangue del paziente, modificate geneticamente in modo tale da esprimere sulla loro superficie il recettore CAR capace di aumentare la risposta immunitaria per riconoscere e distruggere i bersagli delle cellule tumorali e reinfuse nel paziente stesso.
Ogni dose, quindi, viene sviluppata e prodotta per un singolo paziente, partendo dalle sue stesse cellule immunitarie. Inoltre, a differenza della strategia basata sugli inibitori dei checkpoint (anticorpi per disinnescare i freni del sistema immunitario e aumentare così la capacità dei linfociti di fronteggiare i tumori), le cellule CAR-T rappresentano la medicina personalizzata nel campo dei tumori
La sua efficacia clinica, come evidenziato in precedenza, è stata dimostrata nelle neoplasie ematologiche con due terapie a base di cellule CAR-T approvate dalla FDA nel 2017 e dall’EMA nel 2018 per il trattamento della leucemia linfoblastica acuta nei bambini e dei linfomi avanzati negli adulti. Nonostante ciò, la ricerca su altri potenziali trattamenti, in particolare per i tumori solidi, è tuttora in corso anche se sono necessari miglioramenti futuri nella scelta dei vettori e nell’evitare gli effetti collaterali.
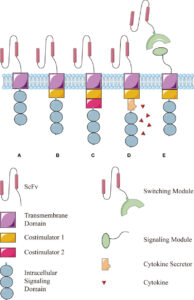
Struttura delle cellule CAR-T
Il termine CAR (Chimeric Antigen Receptor) identifica un recettore trans-membrana chimerico che viene introdotto all’interno di un linfocita T competente attraverso una trasfezione (introduzione di materiale genetico esogeno o transgene in cellule riceventi) per mezzo di vettori virali (Lentivirus o Retrovirus).
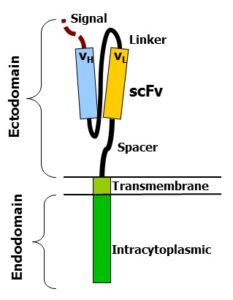
Il TCR del linfocita (Recettore Transmembrana sulla sua superficie che è responsabile del riconoscimento di peptidi associati al complesso maggiore di istocompatibilità) viene quindi sostituito dalla proteina ibrida CAR che è costituito da tre domini (unità strutturali e funzionali di una proteina cioè regioni globulari compatte che si formano per combinazioni specifiche di strutture secondarie come α-eliche, foglietti β, sequenze non ripetitive cioè conformazioni a forma di spirale coil o di cappio loop): un dominio extracellulare, un dominio transmembrana e un dominio intracellulare.
DOMINI DEL CAR
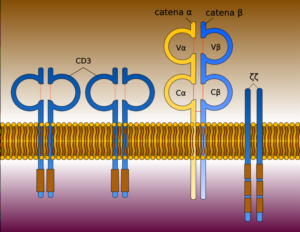
Il dominio extracellulare, la sezione della proteina di membrana esterna al citoplasma e aperta allo spazio extracellulare, è responsabile del riconoscimento dell’antigene da parte della cellula CAR-T ed è costituito da un segmento variabile a singola catena (scFv o single chain variable segment) derivante dall’unione, mediante un linker, di un segmento della catena leggera (VL) e di uno della catena pesante (VH) delle immunoglobuline.
Il dominio intracellulare è invece deputato all’attivazione del linfocita T e si basa sulla fosforilazione di ITAM (Immunoreceptor Tyrosine-based Activation Motif, sequenza conservata di 4 aminoacidi che si ripete due volte nelle code citoplasmatiche dei recettori fosforilati in tirosina non catalitici, proteine della superficie cellulare che si trovano principalmente sulle cellule immunitarie, il cui ruolo principale è quello di essere parte integrante per l’avvio di una varietà di vie di segnalazione e successivamente l’attivazione delle cellule immunitarie) presente del dominio citoplasmatico di CD3ζ .
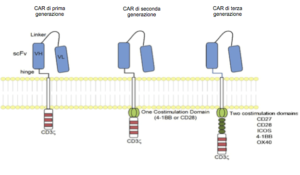
CAR -T di differenti generazioni
La composizione strutturale differente del dominio intracellulare determina delle CAR -T di differenti generazioni.
La prima generazione di CAR-T è costituita dalla singola catena CD3ζ senza la presenza di un segnale costimolatorio mentre la seconda e la terza generazione di CAR-T presentano all’interno del dominio intracellulare, in combinazione con la catena CD3ζ delle molecole costimolatorie rispettivamente CD28 o CD137 (4 – 1 BB) o singolarmente o in associazione. In definitiva, il dominio intracellulare è il luogo in cui i recettori si raggruppano per attivare un segnale di riconoscimento dell’antigene che viene poi trasmesso alla cellula T.
Ingegnerizzazione delle cellule CAR-T per la terapia del cancro
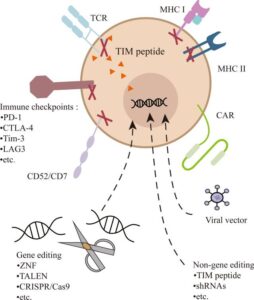
La terapia con cellule CAR-T richiede la raccolta di cellule T dal sangue del paziente o del donatore. Il linfocita T viene ingegnerizzato attraverso l’utilizzo di vettori virali o alternativamente con metodologie non virali (liposomi e coniugati molecolari).
Attualmente, i metodi più consolidati di produzione delle cellule CAR-T si avvalgono di piattaforme con vettori virali (Lentivirus o Retrovirus). Attraverso il virus viene trasdotta la sequenza genica del dominio di riconoscimento antigenico, che generalmente deriva dalle porzioni variabili delle catene anticorpali o del TCR.
Tale dominio viene espresso sulla membrana del linfocita T e una porzione transmembrana lo lega alla porzione intracellulare del recettore rappresentata dalla catena ζ del CD3, responsabile della trasduzione del segnale e della attivazione del linfocita T.
specificità antigenica al linfocita T
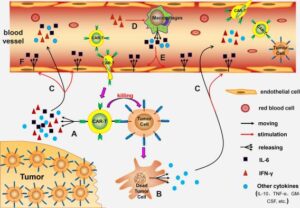
Questo tipo di struttura permette di combinare la specificità del riconoscimento anticorpale MHC – indipendente con le potenzialità anti – tumorali dei linfociti T, conferendo così qualsiasi specificità antigenica al linfocita T.
Questi linfociti CAR, definiti di prima generazione hanno presentato una importante capacità di riconoscimento delle neoplasie in vitro, associata, però, ad una limitata attività anti -tumorale in vivo dovuta all’esaurimento funzionale e all’anergia dei linfociti CAR-T.
Con lo sviluppo di recettori CAR-T di seconda e terza generazione, caratterizzati rispettivamente dall’inserimento all’interno della porzione intracellulare di domini costimolatori (CD28 , 4 – 1BB) e di multipli domini di trasduzione del segnale (CD27, CD28, ICOS, 4 – 1BB, OX 40), sono state prodotte nuove cellule CAR-T con una attività anti -tumorale e una persistenza ulteriormente incrementate.
Usi clinici delle cellule CAR -T
Il bersaglio ideale per la terapia con cellule CAR-T sono i marcatori di superficie cellulare che sono espressi o sovraespressi esclusivamente sulla maggior parte delle cellule tumorali con pochissima o nessuna espressione sui tessuti normali. Gli obiettivi per le cellule CAR-T includono:
a) Antigeni sovraespressi come il recettore del fattore di crescita epidermico (EGFR) e il recettore 2 del fattore di crescita epidermico umano (HER2),
b) Proteine glicosilate aberranti come la mucina 1 (MUC1),
c) Antigeni oncofetali come l’antigene carcinoembrionale (CEA),
d) Proteine dello stroma associate al tumore come la proteina attivante i fibroblasti (FAP),
e) Antigeni immunomodulatori come il ligando di morte programmata 1 (PD-L1) e alcuni cluster di antigeni di differenziazione (ad es. CD19, CD22).
Tumori Studiati
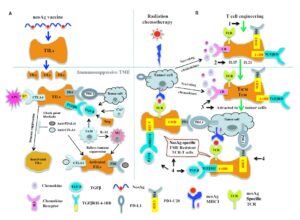
Ad oggi, i tumori studiati per il trattamento con questi marcatori includono il cancro del polmone, il cancro del timo, il cancro esofageo, il mesotelioma pleurico e alcune leucemie.
I primi studi hanno utilizzato le cellule CAR-T per colpire le neoplasie ematologiche CD19-positive, come il linfoma follicolare, la leucemia linfocitica acuta (LLA) e il linfoma mantellare. La cellula CAR-T ha mostrato risposte efficaci, con circa il 65-100% dei pazienti con LLA che hanno raggiunto la remissione completa. Questa ricerca ha anche portato allo sviluppo di cellule CAR-T anti-CD22 che possono essere utilizzate in pazienti con LLA CD22. Gli studi clinici stanno anche tentando di inserire geni suicidi nelle cellule CAR-T che possono essere attivati per ucciderle; questo è effettivamente un interruttore di sicurezza molecolare.
Sebbene la terapia con cellule CAR-T abbia mostrato efficacia clinica nel trattamento delle neoplasie ematologiche, per quanto riguarda i risultati sui tumori solidi sono risultati meno efficaci. La perdita di antigene riportata nelle cellule tumorali porta a una riduzione del numero di antigeni unici e del microambiente immunosoppressivo dei tumori solidi. La combinazione di cellule CAR-T con altre molecole effettrici può rivelarsi una strategia superiore per il trattamento dei tumori solidi.
Attuali terapie con cellule CAR-T
 Le seguenti terapie con cellule CAR-T approvate dall’EMA sono progettate per trattare malattie come il mieloma multiplo, il linfoma e la leucemia.
Le seguenti terapie con cellule CAR-T approvate dall’EMA sono progettate per trattare malattie come il mieloma multiplo, il linfoma e la leucemia.
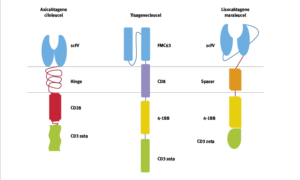
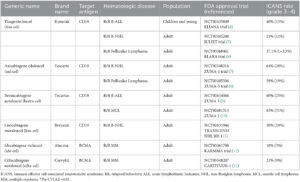
• Kymriah (Tisagenlecleucel) di Novartis è stato approvato per la prima volta nel 2017 ed è progettato per il trattamento della leucemia linfoblastica acuta a cellule B (LLA) e del linfoma non-Hodgkin a cellule B (NHL).
• Nel 2017 è stato approvato anche Yescarta (Axicabtagene ciloleucel) di Kite Pharma (Gilead) ed è progettato per il trattamento del linfoma non-Hodgkin a cellule B (NHL) e del linfoma follicolare.
Terapie
 • Tecartus (Brexucabtagene autoleucel) è un altro sviluppo di Kite Pharma (Gilead) ed è stato approvato nel 2020. È progettato per il trattamento del linfoma mantellare (MCL) e della leucemia linfoblastica acuta a cellule B (LLA).
• Tecartus (Brexucabtagene autoleucel) è un altro sviluppo di Kite Pharma (Gilead) ed è stato approvato nel 2020. È progettato per il trattamento del linfoma mantellare (MCL) e della leucemia linfoblastica acuta a cellule B (LLA).
• Breyanzi (Lisocabtagene maraleucel) di Juno Therapeutics (Bristol-Myers Squibb) è stato approvato nel 2021 e progettato per il trattamento del linfoma non-Hodgkin a cellule B (NHL) (Fig.15)
• Abecma (Idecabtagene vicleucel) di Celgene (Bristol-Myers Squibb) è stato approvato nel 2021 e progettato per il trattamento del mieloma multiplo.
• Carvykti (Ciltacabtegene autoleucel) di Janssen Biotech (Johnson & Johnson) è stato approvato nel 2022 e progettato per il trattamento del mieloma multiplo.
Sebbene la terapia con cellule CAR-T si sia dimostrata efficace, non tutti i pazienti rispondono al trattamento in modo simile. In alcuni casi, si osserva anche recidiva o resistenza al trattamento e ciò può essere attribuito all’esaurimento delle cellule T.
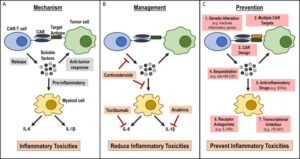
Effetti collaterali e loro gestione
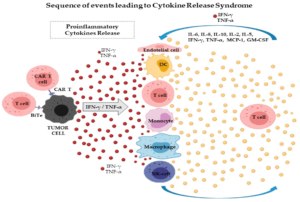
Una importante limitazione della terapia con cellule CAR-T è una potenziale induzione della sindrome da rilascio di citochine (CRS). Le cellule T rilasciano citochine che agiscono come messaggeri per dirigere la risposta immunitaria. Durante la sindrome da rilascio di citochine, il rapido rilascio di citochine infiammatorie e la successiva attivazione di più globuli bianchi causano sintomi gravi e talvolta fatali, come febbre alta, bassa pressione sanguigna , convulsioni e può persino causare insufficienza d’organo.
Questi sintomi insorgono a causa della produzione di elevate quantità di citochine infiammatorie come IL-6, TNFα e IFNγ. Gli agenti bloccanti l’ IL-6 e i corticosteroidi possono essere utilizzati per gestire i sintomi della CRS grave senza ridurre l’efficacia del trattamento con cellule CAR-T.
ALTRI EFFETTI COLLATERALI
Un’altra grande preoccupazione quando si utilizzano le cellule CAR -T è una tossicità “effetto fuori bersaglio” o “off target“, che si traduce nella distruzione dei tessuti normali che purtroppo esprimono anche l’antigene bersaglio. L’aplasia delle cellule B si verifica quando le cellule CAR-T anti-CD19 uccidono i normali linfociti B che esprimono CD19. Tutto questo può essere gestito con la terapia sostitutiva con gammaglobuline, per fornire gli anticorpi necessari per combattere le infezioni.
Un altro effetto collaterale fatale e grave osservato di recente è il gonfiore del cervello (edema cerebrale), ma questo evento sembra essere relativamente raro. Altri effetti collaterali legati alla neurotossicità sono stati osservati anche in studi clinici ma tutti reversibili e di breve durata. Poichè le cellule CAR-T possono avere alcuni gravi effetti collaterali e tossicità, migliorare la sicurezza di queste cellule è, pertanto, un argomento di ricerca estremamente importante.
Conclusioni
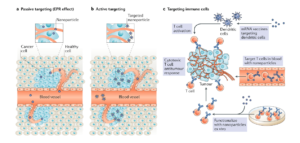
Considerando l’efficacia e l’approccio delle terapie con cellule CAR-T, in questi ultimi anni si stanno ottimizzando strategie di trattamento per espanderne l’applicazione e l’efficacia.
Oltre alle cellule T, anche le cellule natural killer (NK) e i macrofagi vengono testati per lo sviluppo di terapie CAR. Inoltre, terapie combinatorie, come l’uso di inibitori del checkpoint immunitario con cellule CAR-T sono in fase di sperimentazione clinica.
Mentre tutte le terapie a base di cellule CAR-T attualmente approvate sono autologhe, ulteriori lavori si stanno concentrando sullo sviluppo di strategie allogeniche. Ciò consentirebbe al settore di disporre di un’opzione pronta all’uso per il trattamento dei pazienti che elimina le sfide di quantità e qualità del materiale di partenza associate alle terapie autologhe.
Bibliografia:
- Gross G, Waks T & Eshhar Z (1989) “Expression of immunoglobulin-T-cell receptor chimeric molecules as functional receptors with antibody-type specificity“ Proc. Natl. Acad. Sci. USA Vol. 86, pp. 10024
- David L. Porter, M.D., Bruce L. Levine, Ph.D., Michael Kalos, Ph.D., Adam Bagg, M.D., and
Carl H. June, M.D.: “Chimeric Antigen Receptor–Modified T Cells in Chronic
Lymphoid Leukemia“; N Engl J Med. 2011 August 25; 365(8): 725–733. doi:10.1056/NEJMoa1103849 - Maus MV et al (2016) “An MHC restricted antibody based chimeric antigen receptor requires TCR like affinity to maintain antigen specificity“ Mol Ther Oncolytics 3 : 16023
- Bonifant CL et al (2016) “Toxicity and management in CAR – T cell Therapy” Mol Ther Oncolytics 3: 16011
- Norelli M et al (2016) “Clinical pharmacology of CAR-T cells: Linking cellular pharmacodynamics to pharmacokinetics and antitumor effects“; Biochim Biophys Acta 1865(1):90
- Zhang C et al (2017) “Engineering CAR – T cells“; Biomark Res 5: 22
- D’Aloia MM et al (2018) “CAR – T cells: the long and winding road to solid tumors“; Cell Death & Disease 9: 282
- Majzner RG & Mackall CL (2018) “Tumor Antigen Escape from CAR T-cell Therapy“. Cancer Discov 8 (10) : 1219
- Shimabukuro-Vornhagen A et al (2018 ) “Cytokine release syndrome“. J Immunother Cancer 6 (1) : 56
- Lin H et al (2021) “Advances in Universal CAR-T Cell Therapy“ . Frontiers in Immunol 12 : 744823
- Tallantyre EC et al (2021) “Neurological updates: neurological complications of CAR-T therapy“ . J Neurol 268 (4) : 1544 .
- Miao L et al (2021) “Reactions Related to CAR-T Cell Therapy“. Frontiers in Immunol. 12: 663201.
- Fischer JW et al (2021) “CAR-T Cell Therapy: Mechanism, Management, and Mitigation of Inflammatory Toxicities” . Frontiers in Immunol. 12 : 693016
- Wei F (2022) “Emerging Strategies in TCR-Engineered T Cells“ . Frontiers in Immunology 13: 850358.
- Ahmad U et al (2022) “Chimeric antigen receptor T cell structure, its manufacturing, and related toxicities A comprehensive review“. Advances in Cancer Biology – Metastasis v. 4 Review.
Le figure sono state estrapolate dai siti:
- https://www.news-medical.net/life-sciences
- https://www.ematologiainprogress.it/
- https://grandangoloinematologia.accmed.org/
- https://www.sismed-it.com/
- https://it.wikipedia.org/