La Glicolisi o via di Embden–Meyerhof–Parnas
- Articolo del prof. Sergio Barocci – Università di Genova per la terza età
La Glicolisi
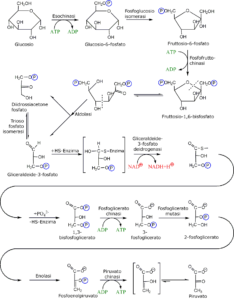
La glicolisi o via di Embden–Meyerhof–Parnas, rappresenta la prima via di demolizione del glucosio, il monosaccaride più diffuso e ad alto contenuto energetico quantificabile, presente in tutti i sistemi biologici insieme ad altri esosi (carboidrati a 6 atomi di carbonio) come il galattosio e il fruttosio. Il glucosio può derivare da reazioni di scomposizione esoergoniche o idrolitiche di polisaccaridi o di disaccaridi.
Di norma nel nostro organismo viene assorbito il 97% dei carboidrati introdotti con la dieta, e di conseguenza si ha lo sviluppo di un calore medio di 4 Kcal.
Questa via metabolica consiste in una sequenza di reazioni chimiche in grado di convertire il glucosio in acido piruvico con concomitante produzione di ATP.
Le tappe storiche

Negli organismi aerobici, il cui metabolismo si basa sull’utilizzo dell’ossigeno molecolare O2, che funge da accettore finale di elettroni, la glicolisi è il preludio al ciclo di Krebs o degli acidi tricarbossilici e alla catena del trasporto di elettroni per mezzo della quale viene recuperata la maggior parte dell’energia libera presente nel glucosio.
Le tappe storiche che portarono al chiarimento della via glicolitica richiesero molti decenni di lavoro. Una scoperta fondamentale venne fatta dai due fratelli tedeschi, il medico Hans Buchner e il chimico Eduard Buchner nel 1897, quasi per caso (1).
Essi erano interessati a preparare estratti extracellulari di lievito per possibili usi terapeutici. Tali estratti dovevano essere conservati senza l’aggiunta di antisettici come il fenolo e così decisero di provare il saccarosio, normalmente usato come conservante in cucina.
Un processo di fermentazione a-cellulare

Essi, ottennero un risultato straordinario: una volta aggiunto il saccarosio, immediatamente nella soluzione si svilupparono bollicine. Era in atto una fermentazione il cui prodotto finale era alcol etilico cioè il saccarosio si era rapidamente trasformato in alcool dall’estratto di lievito. Il significato di questa scoperta ebbe effetti straordinari. Con la motivazione “per le sue ricerche biochimiche e la scoperta della fermentazione senza cellule” Eduard Buchner ricevette il Premio Nobel per la Chimica nel 1907.
Si ebbe così la prima dimostrazione della capacità catalitica degli estratti di lievito nella fermentazione anche in assenza di cellule viventi.
Infatti, dagli anni sessanta dell’ottocento si riteneva, grazie ai risultati sperimentali ottenuti dal microbiologo francese Louis Pasteur (1822 – 1895) e pubblicati come “Mémoire sur la fermentation appellée lactique” (2), che la fermentazione fosse inseparabile dalla struttura cellulare, e cioè che i processi metabolici fossero possibili solo all’interno di una struttura vivente, come una cellula.
L’AGGIUNTA DEL FOSFATO INORGANICO

La scoperta dei fratelli Buchner confutava una teoria nota a quel tempo come vitalismo cioè una corrente di pensiero che esaltava la vita intesa principalmente come forza vitale energetica e fenomeno spirituale al di là del suo aspetto biologico materiale, aprendo così il campo alla moderna biochimica. Da questo momento, il metabolismo divenne chimica.
Il contributo successivo arrivò dai biochimici inglesi Arthur Harden (3.4) e William Young nel 1905.
Harden e Young aggiunsero estratti di lievito ad una soluzione di glucosio e videro che la fermentazione iniziava immediatamente.
La velocità della fermentazione diminuiva però presto a meno che non venisse aggiunto del fosfato inorganico. Essi pensarono che il fosfato inorganico venisse incorporato negli zuccheri.
HARDEN E YOUNG

Isolarono così un esoso difosfato che più tardi fu dimostrato essere il fruttosio 1,6 bifosfato, un intermedio fondamentale della glicolisi.
Inoltre, trovarono che l’estratto di lievito perdeva la sua attività una volta dializzato o scaldato alla temperatura di 50°C. L’estratto dializzato inattivo riacquistava l’attività iniziale se veniva mescolato con estratto inattivo scaldato. Quindi, l’attività dipendeva dalla presenza di due tipi di sostanze: un componente instabile al calore e non dializzabile (indicato come zimasi) e uno stabile al calore ma dializzabile (indicato come cozimasi).
Oggi, si conosce che lo “zimasi” è costituito da un certo numero di enzimi e che il “cozimasi” è invece costituito da ioni metallici, adenosina trifosfato o ATP, adenosina difosfato o ADP e coenzimi come il nicotinamide adenin dinucleotide o NAD+..
ZIMASI E COZIMASI

Alcuni anni dopo, studi condotti su estratti di muscolo hanno dimostrato che molte delle reazioni della fermentazione lattica erano le stesse di quelle della fermentazione alcolica. Questa rappresentava una importante scoperta in quanto introduceva il concetto di unitarietà in biochimica.
Arthur Harden riceverà il Premio Nobel per Chimica nel 1929 con la menzione: “per le ricerche sulla fermentazione dello zucchero e degli enzimi fermentativi”.
La via glicolitica completa venne chiarita nel 1940 in gran parte grazie ai contributi del chimico tedesco Gustav G. Embden, del biochimico tedesco Otto F. Meyerhof e del biochimico polacco Jakub Parnas, ma anche dal chimico tedesco-statunitense Carl Neuberg, dal fisiologo tedesco Otto Warburg e dai biochimici cechi Gerty T. Cori (1896 – 1957) e Carl F. Cori (1896 – 1984) entrambi vincitori del Premio Nobel per la Medicina nel 1947 (5 – 11). Nel 1958 venne determinata la sequenza completa delle sue reazioni metaboliche.
via di Embden – Meyehof – Parnas
Il processo biochimico della glicolisi viene anche detto via di Embden – Meyehof – Parnas e la reazione complessiva dell’intera via è:
C6H12O6 + 2NAD+ + 2ADP + 2Pi → 2C3H3O3– + 2H+ + 2NADH + 2ATP + 2H2O
Dalla conversione del glucosio in due molecole di piruvato vengono, quindi, generate 2 molecole di ATP e 2 di NADH.
Caratteristiche chimiche degli intermedi della via glicolitica

Gli intermedi della glicolisi possiedono sei oppure tre atomi di carbonio. Tutte le unità a sei atomi di carbonio sono derivati del glucosio e del fruttosio.
Le unità a tre atomi di carbonio sono invece derivati del diidrossiacetone, della gliceraldeide, del fosfoglicerato e del piruvato.
Tutti gli intermedi tra il glucosio e il piruvato sono fosforilati e i gruppi fosforici in questi composti si legano sia con legami estere che con legami anidride.
La glicolisi avviene in dieci tappe in cui vengono svolte principalmente due funzioni:
- Degradare il glucosio per generare ATP.
- Produrre precursori per la biosintesi di componenti cellulari.
Le reazioni fondamentali della via glicolitica
Tutte le reazioni hanno luogo nel citosol della cellula in assenza di ossigeno (anaerobiosi), sono comuni sia nei procarioti che negli eucarioti, e portano alla formazione di cofattori ridotti (NADH), ATP e piruvato.
La prima fase è preparatoria di investimento energetico (tappe 1-5, dove si consumano 2 molecole di ATP) mentre la seconda fase è di produzione di energia (tappe 6-10), dove si ha la formazione di 2 molecole di ATP.
Prima fase della glicolisi

I – II – III tappa: conversione del glucosio in fruttosio 1,6- bisfosfato che consiste in: a) una fosforilazione, b) una isomerizzazione, c) una seconda fosforilazione.
Le due fosforilazioni ATP-dipendenti sono due reazioni fortemente esoergoniche (reazioni in cui il contenuto di energia dei prodotti è diminuito rispetto a quello dei reagenti cioè si è avuta una liberazione di energia verso l’esterno), che creano due passaggi irreversibili che avvengono all’inizio della via metabolica in condizioni lontane dall’equilibrio.
Queste due fosforilazioni fanno in modo che tutti gli intermedi glicolitici siano fosforilati e che, essendo dotati di carica netta negativa, non possono diffondere all’esterno della cellula. La presenza di gruppi fosforici nei substrati rende le reazioni enzimatiche più specifiche, in quanto gli enzimi della glicolisi legano gli intermedi glicolitici interagendo in grande misura con i loro gruppi fosforici.
DUE FOSFORILAZIONI NELLE PRIME TRE TAPPE
In definitiva, lo scopo di queste prime cinque tappe è quello di intrappolare il substrato nella cellula e formare un composto da scindere facilmente in unità fosforilate a tre atomi di carbonio mentre l’ATP viene successivamente estratto dalle unità a tre atomi di carbonio.
I tappa: fosforilazione del glucosio
Il glucosio entra nelle cellule ad opera di particolari trasportatori (GLUT o glucotrasportatori che consentono il passaggio del glucosio attraverso la membrana plasmatica; nell’uomo esistono numerose isoforme di GLUT, indicate con numeri crescenti: GLUT-1, GLUT-2, GLUT-3, GLUT – 4, GLUTn) (Fig. 9) ed ha un destino fondamentale cioè quello di essere fosforilato dall’ATP per formare Glucosio-6 fosfato.
Il trasferimento del gruppo fosforico dall’ATP al gruppo OH sul C-6 del glucosio viene catalizzato dall’esochinasi (le esochinasi sono enzimi che provvedono al trasferimento di un gruppo fosforico dall’ATP ad un accettore che in questo caso è rappresentato da un esoso come il glucosio). L’esochinasi è un enzima ubiquitario poco specifico che catalizza la fosforilazione di vari esosi (D-glucosio, D-Mannosio, D-Fruttosio) e come tutte le altre chinasi, richiede la presenza di ioni Mg++ o anche di ioni Mn++ per l’espressione della sua attività catalitica (gli ioni Mg++ hano la funzione di schermare le cariche negative degli atomi di ossigeno sui gruppi fosforici e β oppure β e rendendo l’atomo di fosforo più suscettibile all’attacco nucleofilo del gruppo C6-OH del glucosio)
In questa prima tappa viene aggiunto un gruppo fosfato al glucosio 6C e consumata una molecola di ATP.
II e III tappa: isomerizzazione del Glucosio 6-fosfato a cui segue una seconda fosforilazione che trasforma il glucosio in fruttosio 1,6-bisfosfato
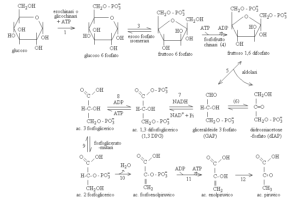
La tappa successiva della glicolisi è, quindi, l’isomerizzazione del Glucosio 6-fosfato in Fruttosio 6-fosfato, reazione catalizzata dalla fosfoesoso-isomerasi. L’anello piranosico a sei membri del Glucosio 6-fosfato viene convertito nell’anello furanosico a cinque membri del Fruttosio 6-fosfato (la catena aperta del glucosio ha un gruppo aldeidico –CHO sul C-1 mentre la forma a catena aperta del fruttosio ha un gruppo chetonico = CO sul C-2.
Il gruppo aldeidico sul C-1 reagisce con il gruppo ossidrilico –OH sul C-5 formando un anello piranosico. Il gruppo chetonico sul C-2 reagisce, invece, con il gruppo ossidrilico –OH sul C-5 generando un anello furanosico. Pertanto, la isomerizzazione del Glucosio 6-fosfato a Fruttosio 6- fosfato non rappresenta altro che la conversione di un aldoso (glucosio) in un chetoso (fruttosio) (apertura dell’anello, isomerizzazione, chiusura dell’anello).
Alla tappa di isomerizzazione segue una seconda fosforilazione dove il Fruttosio 6-fosfato viene fosforilato dall’ATP a Fruttosio 1,6-bisfosfato (Il termine bisfosfato indica che i due gruppi fosforici sono separati mentre il termine difosfato come nell’ADP indica che i due gruppi fosforici sono legati fra loro da un gruppo anidrinico.
Questa è la ragione per la quale si preferisce utilizzare il nominativo di Fruttosio 1,6 bisfosfato. La reazione metabolica viene catalizzata dalla fosfofruttochinasi, un enzima allosterico tetramerico che si trova in due stati conformazionali R (stato rilassato) e T (stato teso) in equilibrio (gli enzimi allosterici sono enzimi la cui attività può essere modificata dalla presenza di altre molecole i cosiddetti effettori allosterici che possono essere attivatori o inibitori , i quali si legano all’enzima in un sito regolatore diverso dal sito catalitico (che si lega al substrato).
L’ATP , in questo caso è sia substrato sia inibitore allosterico. La velocità complessiva della glicolisi dipende criticamente dai livelli della fosfofruttochinasi (principale elemento di controllo della glicolisi) che viene regolata allostericamente dalle concentrazioni di ATP e di altri metaboliti
IV e V tappa: lisi di 6 atomi di C con formazione della gliceraldeide 3-fosfato per scissione e isomerizzazione

Queste due successive tappe della via glicolitica iniziano la prima con la scissione del Fruttosio 1,6 bisfosfato in due prodotti rispettivamente gliceraldeide 3-fosfato ( circa 90 %) e diidrossiacetone fosfato (circa il 10%) , reazione catalizzata dalla aldolasi, un enzima che catalizza l’inverso di una condensazione aldolica (scissione aldolica) a cui segue l’interconversione dei due trioso-fosfati.
La scissione aldolica avviene sulla forma aperta del substrato mediante catalisi covalente ( si ha la formazione di una base di Schiff protonata quando un reagente nucleofilo come il gruppo - aminico di un residuo di lisina del sito attivo dell’aldolasi attacca il gruppo carbonilico del fruttosio 1,6 bisfosfato; si ha rottura del legame tra C3 e C4 in quanto l’idrogeno del gruppo -OH del C4 viene strappato dall’ ossigeno di una tirosina e si libera gliceraldeide 3-fosfato e si ha formazione di enammina poi l’enammina viene quindi protonata a catione imminico) e catalisi acido-base ( l’idrogeno di una istidina si lega al C3 donando un H+ ; a questo punto il catione imminico si idrolizza liberando diidrossiacetone fosfato e si ha rigenerazione dell’enzima). Il diidrossiacetone-fosfato (chetoso) viene convertito tutto in gliceraldeide-3 fosfato (aldoso) che passa dal 90% iniziale al 100% dei prodotti. L’isomerizzazione di questi due composti a tre atomi di carbonio è catalizzata dalla trioso fosfato isomerasi. L’isomerizzazione porta ad un intermedio enendiolico il quale permette l’interconversione della gliceraldeide 3-fosfato e del dididrossiacetone
In questa prima fase della glicolisi, un esoso viene fosforilato, isomerizzato, scisso in due triosofosfati interconvertibili e consumate due molecole di ATP. Quindi, si ha un bilancio energetico negativo, in quanto i gruppi fosforici vengono trasferiti dall’ATP all’esoso. Da qui in avanti ci saranno due linee di percorso parallele di composti a tre atomi di carbonio che si svilupperanno sino alla formazione di acido piruvico che rappresenta il prodotto finale di questa via metabolica.
Nella seconda fase della glicolisi i due gruppi fosforici provenienti dalla molecola dell’ATP introdotti nell’esoso nella prima fase, vengono entrambi ricuperati nella seconda, sotto forma di ATP.
Seconda fase
VI tappa: la sintesi di 1,3 bisfosfoglicerato e di NADH

Le precedenti tappe della glicolisi hanno trasformato una molecola di glucosio in due molecole di gliceraldeide 3-fosfato senza estrazione ancora di energia. Contrariamente, sono state, invece, consumate due molecole di ATP. Ora, le successive reazioni raccolgono parte dell’energia contenuta nella gliceraldeide 3-fosfato e la reazione iniziale consiste nella conversione di questo composto in 1,3 bisfosfoglicerato, reazione catalizzata dalla gliceraldeide 3-fosfato deidrogenasi.
Ad ogni molecola di fosfogliceraldeide 3-fosfato vengono sottratti 2 elettroni e un protone. Queste particelle vengono affidate a un accettore temporaneo (NAD+) che si riduce a NADH e si aggiunge un nuovo gruppo fosfato.
In poche parole, si tratta di una reazione complessa che accoppia l’ossidazione alla fosforilazione. della gliceraldeide -3 fosfato in cui viene generato un composto ad alta energia, l’acil fosfato 1,3 bisfosfoglicerato, (gli acil-fosfati sono dei composti che hanno un alto potenziale di trasferimento del gruppo fosforico).
L’ossidazione per poter avvenire ha bisogno della rimozione di uno ione idruro (: H-) cioè di un nucleo di idrogeno con due elettroni e ciò accade mediante l’addizione di un reagente nucleofilo come il gruppo sulfidrilico di un residuo di cisteina presente nel sito attivo della gliceraldeide- 3 fosfato deidrogenasi al gruppo carbolico dell’aldeide con formazione di un tioemiacetale.
Successivamente si ha la deprotonazione della gliceraldeide 3 –fosfato con il trasferimento di uno ione idruro al NAD+ associato all’enzima in una posizione molto vicina a quella della cisteina che viene così convertito a NADH mentre il tioemiacetale in seguito alla deprotonazione viene convertito in tioestere un intermedio ad alta energia corrispondente all’acilfosfato. Il NADH si dissocia dall’enzima e viene immediatamente sostituito da un’altra molecola di NAD+.
La presenza di NAD+ favorisce l’ingresso nel sito attivo di un gruppo funzionale carico negativamente, come un gruppo fosfato donato da un ATP. La seconda reazione, consiste invece nello spiazzamento del legame tioestere ad opera del fosfato, che libera così il substrato diventato ormai 1,3-bisfosfoglicerato da ogni legame con l’enzima.
In questo modo viene completamente rigenerato il gruppo sulfidrilico del residuo di cisteina.
VII tappa : formazione di ATP dall’ 1,3 bisfosfoglicerato
La formazione di ATP mediante il trasferimento di gruppi fosforici da un substrato come l’1,3- bisfosfoglicerato viene detta fosforilazione a livello del substrato (si ha produzione di ATP che non implica utilizzo di O2) per distinguerla dalla fosforilazione legata alla respirazione (fosforilazione ossidativa). In questa tappa, si utilizza l’elevato potenziale di trasferimento del gruppo fosforico dell’ 1,3 bisfosfoglicerato per generare ATP in cui avviene la prima formazione di ATP. L’enzima fosfoglicerato chinasi catalizza il trasferimento del gruppo fosforico dall’acil fosfato dell’ 1,3 bisfosfoglicerato producendo ATP e 3fosfoglicerato.
VIII – IX – X tappa: sintesi del secondo composto ad alta energia (formazione del piruvato) e produzione di una seconda molecola di ATP
In queste ultime tre tappe della glicolisi, il 3- fosfoglicerato viene convertito in piruvato e prodotta una seconda molecola di ATP. La prima reazione consiste in un riarrangiamento molecolare nella quale viene spostata la posizione del gruppo fosforico nella conversione dal 3- fosfoglicerato nel 2-fosfoglicerato. Questa reazione viene catalizzata dall’enzima fosfogliceromutasi cioè un enzima in grado di catalizzare lo spostamento all’interno della stessa molecola di un gruppo chimico, in questo caso un gruppo fosforico. E’ una reazione importante per generare un precursore successivo ad alta energia
Nella seconda reazione si forma un enolo per deidratazione del 2-fosfoglicerato. L’enolasi è l’enzima che catalizza la formazione del fosfoenolpiruvato . Questa reazione di deidratazione aumenta significativamente il potenziale di trasferimento del gruppo fosforico mentre un estere fosforico di un alcol normale ha un potenziale basso. Nell’ultima reazione si forma il piruvato e viene generato ATP. Il trasferimento irreversibile del gruppo fosforico dal fosfoenolpiruvato all’ADP è catalizzato dalla piruvico chinasi
Diversi sono i destini del piruvato. Per gli organismi superiori come i mammiferi, la glicolisi ha la particolarità di potere avvenire sia in condizioni di aerobiosi che di anaerobiosi anche se, in quest’ultimo caso viene prodotta una quantità di energia minore
In condizioni di aerobiosi , le molecole di piruvato attraversano le membrane mitocondriali e si portano nella matrice dove vengono trasformate in molecole di acetil coenzima A in un processo che prende il nome di decarbossilazione ossidativa del piruvato. Queste unità acetile attivate possono entrare nel ciclo di Krebs o ciclo degli acidi tricarbossilici e subire una serie di reazioni che ne determinano la completa degradazione ad anidride carbonica e acqua
In condizioni di anaerobiosi, invece, le molecole di acido piruvico vengono degradate in altri composti organici, come acido lattico o acido acetico, mediante il processo di fermentazione.
Bibliografia:
- R.A. Kyle, MA. Shampo (1981) “Eduard Buchner“ JAMA 245, (20) : 2096,
- J. Joaquín Izquierdo (1973) “A flash of genius and the work of Louis Pasteur (1822-1895)” Gac Med Mex 100, (1) : 79 – 80
- R. E. Kohler (1974) “ The background to Arthur Harden’s discovery of cozymase ” Bull Hist Med 48, (1) : 22 – 40
- K. L. Manchester (2000) “Arthur Harden: an unwitting pioneer of metabolic control analysis“ Trends Biochem Sci 25, (2): 89 – 92
- Z. Zielinska (1987) “Jakub Karol Parnas, 1884-1949” Acta Physiol Pol 38(2):91 – 99
- F.F. Nord (1958) “Carl Neuberg; 1877-1956.” Adv Carbohydr Chem 13 : 1 – 7,
- A. Gottschalk (1956) “Prof. Carl Neuberg“ Nature 178, (4536): 722 – 3
- O. H. Warburg (2010) “ The Classic: The chemical constitution of respiration ferment” Clin Orthop Relat Res 468, (11) : 2833 – 2839
- R. A. Brand (2010) “Biographical sketch: Otto Heirich Warburg PhD,MD” Clin Orthop Relat Res, (468) , (11) : 2831 – 2832.
- F. G. Young ,G,(1957) “Gerty T. Cori“ Br Med J, 2, (5054) : 1183 1184,
-
B. A. Houssay (1956) “Carl F. and Gerty T. Cori“ Biochim Biophys Acta 20 (1) : 11 – 16
Riferimenti:
- https://it.wikipedia.org/wiki/Glicolisi
- http://biochimica.bio.uniroma1.it/
- https://www.nobelprize.org/prizes/chemistry/1907/buchner/facts/
- https://en.wikipedia.org/wiki/Hans_Ernst_August_Buchner
- https://en.wikipedia.org/wiki/Eduard_Buchner
- https://en.wikipedia.org/wiki/Arthur_Harden
- https://en.wikipedia.org/wiki/William_John_Young_(biochemist)
- https://www.nobelprize.org/prizes/chemistry/1929/harden/facts/
- https://en.wikipedia.org/wiki/Gustav_Embden
- https://www.britannica.com/biography/Otto-Meyerhof
- https://en.wikipedia.org/wiki/Jakub_Karol_Parnas
- CARL F. CORI and GERTY T. CORI: “Polysaccharide phosphorylase“, Nobel Lectures, December 11, 1947
- https://it.wikipedia.org/wiki/Carl_Alexander_Neuberg