PRIMO TRAPIANTO DI CUORE SUINO GENETICAMENTE MODIFICATO All’uomo
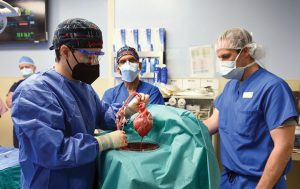
Il trapianto di cuore suino knockout, primo al mondo su un essere umano, è avvenuto a Baltimora, USA, il 7gennaio 2022, una data che potrebbe diventare una pietra miliare nella storia della trapiantologia.
La notizia ha fatto il giro del mondo: l’intervento è stato eseguito negli USA, dall’equipe del prof. Bartley P. Griffith. Questo traguardo è stato reso possibile grazie all’attività di ricerca del prof. Muhammad M. Mohiuddin, direttore del programma di xenotrapianto cardiaco, un medico che è nato ed ha studiato in Pakistan.
L’intervento, eseguito in forma compassionevole, è nella fase sperimentale di un percorso che si spera possa condurre a risultati clinici importanti per la storia della trapiantologia in modo tale da permettere di colmare il gap crescente tra la richiesta di organi e la ridotta disponibilità.
ALCUNE NOTIZIE SUL PRIMO XENOTRAPIANTO DI CUORE TRANSEGENICO
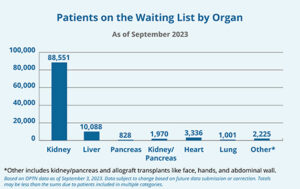
Il paziente, David Bennet, un uomo di 57 anni, è morto il giorno 8 marzo 2022, sopravvivendo due mesi al trapianto. Alcuni aspetti sono davvero interessanti nel percorso sperimentale che ha preceduto questo intervento. Secondo il sito organdonor.gov, al 2023, negli USA, oltre 100 mila persone sono in attesa di un trapianto d’organo. Circa il 40% di essi sono nella fascia d’età tra i 50-65 anni. Ogni giorno, in media, muoiono 17 persone in attesa di un trapianto. La stragrande maggioranza necessita trapianto di rene o fegato; il 3% di essi un nuovo cuore. Attualmente, circa 600.000 pazienti negli Stati Uniti hanno una malattia cardiaca allo stadio terminale.
Lo xenotrapianto (non di organi transgenici), nell’umano, è stato già praticato in passato. Tuttavia, le difficili barriere immunologiche tra i trapianti tra specie diverse ne hanno limitato l’uso immediato. Negli xenotrapianti, al rischio di infezioni opportunistiche comuni nei riceventi di trapianti umani immunodepressi durante la terapia antirigetto di organo, si aggiunge al rischio di esposizione a potenziali agenti patogeni derivati dall’animale di origine.
XENOTRAPIANTI eterotopici SU BABBUINI
Ma la carenza di organi umani da trapiantare, ha richiesto ricerche sulla possibilità di creare organi animali che sostituiscano gli originali gravemente malati.
Nel 2016 sono stati eseguiti studi sperimentali sulla vita di questi cuori transgenici. Il cuore di suino transgenico è stato trapiantato su dei babbuini. In quel caso lo scopo non era studiare la funzione cardiaca del cuore trapiantato ma la sua capacità di rimanere vitale in un altro organismo. Ebbene, vennero trapiantati cuori transgenici suini nell’addome dei babbuini (trapianti eterotopici), che si ritrovarono ad avere così due cuori. In questi esperimenti la sopravvivenza degli animali ha superato tutti i precedenti traguardi, con gli oltre 2 anni di vita con un nuovo organo.
XENOTRAPIANTI ortotopici SU BABBUINI
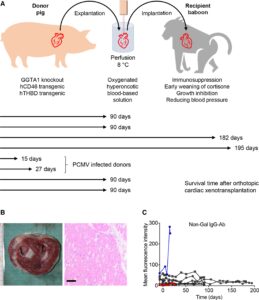 In Germania, nel 2018, presso l’Università di Monaco, un team di ricercatori è riuscito ad eseguire trapianto ortotopico di cuore transgenico da suino in 8 babbuini. Essi sono sopravvissuti per mesi prima di essere stati soppressi in buone condizioni fisiche.
In Germania, nel 2018, presso l’Università di Monaco, un team di ricercatori è riuscito ad eseguire trapianto ortotopico di cuore transgenico da suino in 8 babbuini. Essi sono sopravvissuti per mesi prima di essere stati soppressi in buone condizioni fisiche.
Un fenomeno costante osservato negli esperimenti preclinici di trapianto di cuore era stata la dannosa crescita eccessiva dello xenotrapianto, presumibilmente dovuta al fatto che i maiali d’allevamento erano stati selezionati per una rapida crescita del corpo (e degli organi). Una potenziale soluzione è l’uso di un background genetico più piccolo. A questo proposito, i maiali dell’isola di Auckland erano stati considerati interessanti poiché avevano un peso corporeo da adulti simile a quello umano.
CERCANDO DI SUPERARE BARRIERE IMMUNOLOGICHE (ED ALTRO)

Successivamente questi cuori sono stati trapiantati nei toraci dei babbuini: in questi casi si è visto che la sopravvivenza tendeva ad essere migliore quando il cuore era immerso in un brodo che includeva acqua, ormoni come adrenalina e cortisolo, insieme a cocaina. Come questo ‘brodo‘ aiuti a mantenere sano il cuore non è chiaro.
Il racconto del primo trapianto di cuore transgenico, riportato nel luglio 2022 dal dr Bartley P. Griffith e colleghi della University of Maryland School of Medicine di Baltimora in un articolo sul NEJM, ci descrive molto dei progressi fatti nel campo dell’ingegneria genetica e dei notevoli limiti ancora presenti che dovranno essere superati per rendere diffusa questa tipologia di pratica clinica.
IL PRIMO TRAPIANTO SU UOMO DI CUORE TRANSGENICO

Il sig. David Bennet, che aveva anche una storia di trombocitopenia, è stato ricoverato in ospedale due mesi prima della data del trapianto. Egli era affetto da una grave miocardiopatia non ischemica, con precedente riparazione della valvola mitralica. La frazione di eiezione era arrivata a livelli bassissimi (10%). Il paziente non era candidato alle terapie tradizionali, incluso l’allotrapianto cardiaco.
Il paziente ha avuto molteplici aritmie ventricolari con arresti che hanno portato alla rianimazione ed ha iniziato a ricevere ossigenazione con membrana venoarteriosa periferica extracorporea (ECMO) il 23° giorno di ricovero. Di fronte al rifiuto di due programmi regionali e due nazionali di includere il paziente in lista per il trapianto, il paziente ha accettato di sottoporsi allo xenotrapianto sperimentale.
una degenza particolarmente complicata
Il suo decorso pre-trapianto è stato degno di nota per insufficienza surrenalica, sanguinamento gastrointestinale, batteriemia (che si è risolta con la terapia antimicrobica) e leucopenia indotta da farmaci.
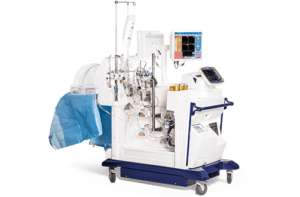
La richiesta alla FDA (Food and Drug Administration) riguardava l’uso combinato di un donatore suino modificato con 10 geni (Revivicor) utilizzando CRISPR/Cas9, un anticorpo monoclonale umanizzato anti-CD40 (Kiniksa Pharmaceuticals) e un sistema di perfusione cardiaca XVIVO (XVIVO Perfusion) per la conservazione della funzionalità cardiaca. La FDA ha valutato l’esperienza preclinica con lo xenotrapianto cardiaco, il modulo di consenso dettagliato e il piano di sorveglianza e di prevenzione della zoonosi.
UN NUOVO CUORE
Revivicor è un’azienda biotecnologica statunitense, con sede in Virginia, che produce organi da maiali geneticamente modificati per superare la grave carenza di organi umani per i trapianti.
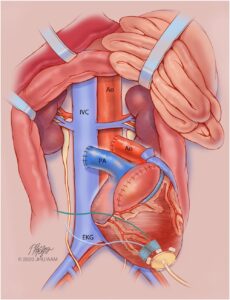
Il sig. Bennet è stato sottoposto a xenotrapianto cardiaco da un animale di origine suina geneticamente modificato il 7 gennaio 2022. Il maiale donatore è stato mantenuto in una struttura biosicura ed è stato svezzato presto dalla madre.
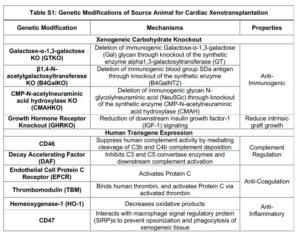
Il cuore innestato aveva dieci modificazioni genetiche: tre geni responsabili della reazione di rigetto erano stati inattivati, il gene responsabile per il recettore dell’ormone della crescita era stato inattivato per ridurre la crescita intrinseca dello xenotrapianto, e sei geni umani erano stati inseriti nel DNA porcino per facilitare l’attecchimento dell’organo.
Le modifiche genetiche includevano tre knockout di carboidrati xenoantigeni immunodominanti: galattosio-alfa-1,3-galattosio, antigene del gruppo sanguigno Sda e acido N -glicolilneuraminico.
Immunosoppressione
Rituximab e globulina antitimocitaria sono stati utilizzati rispettivamente per la deplezione delle cellule B e T, mentre per l’inibizione del complemento è stato utilizzato l’inibitore dell’esterasi C1 del complemento (Berinert, CSL Behring). L’anticorpo monoclonale umanizzato (KPL-404, Kiniksa Pharmaceuticals), utilizzato per bloccare la costimolazione del CD40, è stato somministrato mediante dosi singole ripetute. È stata inoltre somministrata una dose pulsata di metilprednisolone (1000 mg il giorno dello xenotrapianto).
L’allevamento rigoroso dell’animale di origine comprendeva lo svezzamento precoce, l’uso di strutture di biosicurezza e la sorveglianza di routine per gli agenti patogeni.
SORVEGLIANZA DELLe XENOZOONOSI
L’animale di origine deriva da una linea di retrovirus endogeno suino (PERV)-C-negativo ed è stato testato ogni 3 mesi per individuare agenti patogeni che colpiscono la salute umana o suina, tra cui PERV-A, PERV-B, PERV-C, citomegalovirus suino (pCMV ) e herpesvirus linfotropico suino (pLHV). Il test della reazione a catena della polimerasi (PCR) per i patogeni è stato eseguito presso il laboratorio diagnostico veterinario dell’Università del Minnesota.
Dopo lo xenotrapianto, il paziente è stato testato per PERV-A, PERV-B e PERV-C in punti temporali predefiniti. Plasma, siero e cellule mononucleari del sangue periferico (PBMC) sono stati ottenuti nel tempo e conservati per futuri test per le xenozoonosi.
L’ECMO venoarterioso è stato continuato dopo il trapianto a una velocità di 2-3 litri al minuto per supportare lo xenotrapianto. La trachea del paziente è stata estubata dopo la chiusura del torace il secondo giorno dopo il trapianto. La radiografia del torace mostrava campi polmonari chiari.
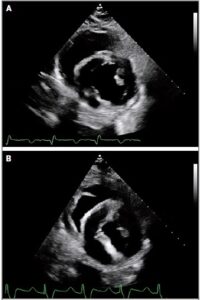
subito dopo il trapianto
Prima della rimozione del catetere Swan-Ganz il giorno 6, la pressione sanguigna sistolica del paziente era in media tra 130 e 170 mm Hg e la sua pressione sanguigna diastolica era in media tra 40 e 60 mm Hg con il trattamento con nicardipina a basso dosaggio. Lo xenotrapianto è rimasto in ritmo sinusale a frequenze comprese tra 70 e 90 battiti al minuto. La Frazione di Eiezione del Ventricolo Sinistro era almeno del 55%. Dal trapianto fino al giorno 45, lo spessore della parete ventricolare sinistra misurava tra 1,2 e 1,4 cm lungo il setto interventricolare basale e la parete posteriore.
Il dodicesimo giorno dopo il trapianto, il paziente riferì di avere dolore addominale. La tomografia computerizzata ha mostrato un ispessimento dell’intestino tenue e del liquido libero, che ha destato preoccupazione per un’ischemia o una perforazione intestinale. Una laparotomia esplorativa ha rivelato liquido purulento in cui crescevano Escherichia coli e Candida tropicalis.
PERITONITE
L’intestino tenue era ispessito e conteneva un’area focale di risoluzione dell’ischemia ma non presentava segni di ischemia acuta o perforazione. L’ecografia intravascolare e l’angiografia mesenterica hanno confermato che il flusso sanguigno era adeguato. Dopo un lavaggio addominale, l’addome del paziente è stato successivamente chiuso senza ulteriori interventi. La sua trombocitopenia è peggiorata fino al nadir di 21.000 piastrine per microlitro ed è rimasta a quel livello fino alla quinta settimana dopo il trapianto, quando la conta piastrinica è salita da 40.000 a 60.000 per microlitro.
Il paziente si riprese dalla peritonite, ma gli obiettivi calorici non potevano essere raggiunti attraverso l’alimentazione enterica; si è sviluppata una diarrea non patogena correlata all’alimentazione tramite sonda che ha portato alla somministrazione della nutrizione parenterale.
Il suo intestino si è lentamente riadattato all’alimentazione enterale e si è adattato entro il 40° giorno dopo il trapianto.
IMMUNOSOPPRESSIONE E PROFILASSI DELLE INFEZIONI

Durante il ricovero, la cachessia del paziente è peggiorata e il suo peso è sceso da 85 kg al momento del ricovero a un nadir postoperatorio di 62 kg.
Dopo la somministrazione dell’immunosoppressione di induzione, le cellule B periferiche (CD20+) e le cellule T (CD3+) erano esaurite. KPL-404 è stato somministrato come parte del regime di immunosoppressione di mantenimento. Nell’immediato periodo postoperatorio, il paziente ha iniziato a ricevere ganciclovir per la profilassi antivirale, isavuconazolo per la profilassi antifungina e atovaquone per la profilassi anti-Pneumocystis jirovecii.
I livelli di anticorpi specifici del donatore sono rimasti al di sotto dei livelli basali dopo l’induzione dell’immunosoppressione e sono rimasti bassi fino al giorno 47 dopo il trapianto, quando si è verificato un forte aumento dei livelli di IgG e, in misura minore, dei livelli di IgM, che corrispondeva alla somministrazione di immunoglobuline per via endovenosa.
valutazioni istologiche
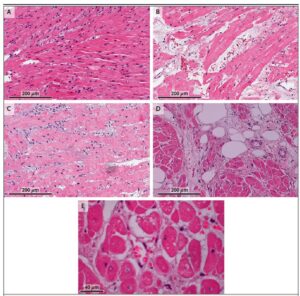
Il giorno 34 dopo il trapianto, una biopsia endomiocardica non ha mostrato evidenza di rigetto. Il paziente è stato in grado di riabilitarsi senza alcun supporto cardiovascolare e lo xenotrapianto ha funzionato normalmente senza evidenza di rigetto.
Il giorno 43 dopo il trapianto, il paziente divenne più sonnolento e la sua trachea fu intubata; si è sviluppata ipotensione, che ha risposto alla somministrazione di liquidi e vasopressina. Una radiografia del torace suggeriva un peggioramento degli infiltrati molli in entrambi i polmoni.
La broncoscopia ha mostrato ulcere superficiali diffuse in tutte le vie aeree primarie e secondarie destre che erano suggestive di infezione virale o fungina, nonostante la profilassi in corso.
Per verificare i risultati del mcfDNA, è stata eseguita la PCR quantitativa su un campione di milza dell’animale di origine e su PBMC del paziente. La milza del donatore è risultata positiva al pCMV, il che indicava che probabilmente l’animale di origine aveva un’infezione latente da pCMV. Di conseguenza, la terapia antivirale è stata modificata da ganciclovir a cidofovir.
Un esame broncoscopico ripetuto eseguito circa 5 giorni dopo ha mostrato la riduzione delle ulcerazioni diffuse delle vie aeree. La trachea del paziente è stata estubata il 47° giorno dopo il trapianto e il paziente ha ripreso la riabilitazione in camera.
FALLIMENTO DELLO XENOTRAPIANTO
La sera del giorno 49, il livello di lattato sierico è aumentato da 4 mg per decilitro a 11,2 mg per decilitro in un periodo di 8 ore in un contesto di lieve disagio e distensione addominale. Si è sviluppata ipotensione, che ha portato al trattamento con vasopressori e la trachea del paziente è stata intubata. Si è sviluppata un’acrocianosi, che ha suggerito una riduzione della gittata cardiaca per la prima volta dopo il trapianto.
Il giorno 56, una biopsia endomiocardica ripetuta ha mostrato un rigetto patologico mediato da anticorpi di ISHLT (International Society for Heart and Lung Transplantation)
di grado 1.
Gli autori hanno concluso che era presente una lesione irreversibile allo xenotrapianto e, con la famiglia del paziente al capezzale del paziente, hanno compassionevolmente ritirato il supporto vitale il 60° giorno dopo il trapianto.
esame post-mortem preliminare
Un esame post-mortem preliminare del cuore ha mostrato un aumento del peso del cuore a 600 g, rispetto a 328 g al momento del trapianto. I miociti cardiaci erano ampiamente distanziati con nuclei centrali separati da sottili bande di fibrosi. La necrosi dei miociti era diffusa ed era associata a una perdita di integrità dei miociti.
I risultati non erano coerenti con il tipico rigetto di xenotrapianto. Sono in corso ulteriori studi per caratterizzare i meccanismi fisiopatologici che hanno provocato questo danno.
riferimenti:
- https://www.facebook.com/SullaFisiologia/posts/3051003028475692
- https://www.facebook.com/SullaFisiologia/posts/3053221181587210
- “Here’s how scientists pulled off the first pig-to-human heart transplant – The effort involved genetic engineering, an experimental drug, and cocaine“, 12 JAN 2022; 4:00 PM, di BYKELLY SERVICK (dal sito Science.org)
- https://www.organdonor.gov/learn/organ-donation-statistics
- “Infectious disease risks in xenotransplantation“, di Jay A. Fishman [Am J Transplant. 2018 Aug;18(8):1857-1864] e REVIEW il 15 dicembre 2022.
- “Researchers keep pig hearts alive in baboons for more than 2 years – Transplant strategy sets survival record, raising new hope humans could benefit from animal organs“, 5 APR 2016, di BYKELLY SERVICK (dal sito Science.org)
- CV del dott. Muhammad M. Mohiuddin (dal sito della Facoltà di Medicina dell’Università del Maryland)
- “Pathways to Clinical Cardiac Xenotransplantation“, di Reichart, Bruno MD; Längin, Matthias MD; Denner, Joachim PhD; Schwinzer, Reinhard PhD; Cowan, Peter J. PhD; Wolf, Eckhard DVM [Transplantation. 2021 Sep 1;105(9):1930-1943]
- “University of Maryland School of Medicine Faculty Scientists and Clinicians Perform Historic First Successful Transplant of Porcine Heart into Adult Human with End-Stage Heart Disease“, For Immediate Release January 10, 2022
- https://en.wikipedia.org/wiki/Bartley_P._Griffith
- “Genetically Modified Porcine-to-Human Cardiac Xenotransplantation“, by Bartley P. Griffith, M.D., Corbin E. Goerlich, M.D., Ph.D., Avneesh K. Singh, Ph.D., Martine Rothblatt, Ph.D., Christine L. Lau, M.D., Aakash Shah, M.D., Marc Lorber, M.D., Alison Grazioli, M.D., Kapil K. Saharia, M.D., Susie N. Hong, M.D., Susan M. Joseph, M.D., David Ayares, Ph.D., et al. [N Engl J Med 2022; 387:35-44]
- https://www.youtube.com/watch?v=iC2zOdCI0vI
- https://www.youtube.com/watch?v=ZBWYk9mDXmo
- https://www.youtube.com/watch?v=byizwND8FkQ
- https://www.revivicor.com/
- https://www.virginiabusiness.com/article/revivicors-100-million-pig-organ-facility-moves-forward/