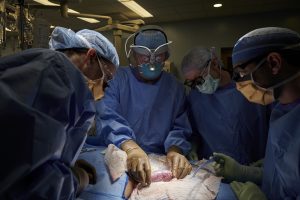
Il primo esperimento di trapianto di rene di maiale in un essere umano
Il 25settembre 2021 il Dr. Robert Montgomery, direttore dell’Istituto di Trapianti della New York University Langone, e il suo team hanno sperimentato un trapianto di rene di maiale Gal -knockout dietro consenso familiare, in una donna dichiarata morta cerebralmente, con segni di disfunzione renale che non soddisfacevano ai requisiti per la donazione di organi ad altri pazienti in lista d’attesa, tenuta in vita artificialmente con ventilazione.
UN RENE COLLEGATO AL CORPO UMANO
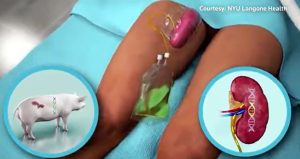
Il rene è stato collegato esternamente al corpo e durante le 54 ore di osservazione ha eliminato una quantità di urina tale da migliorare il livello di creatinina senza dare luogo a problemi legati al rigetto, fino a che non è stata sospesa la respirazione artificiale che teneva in vita la ricevente.
L’intervento ha rappresentato una svolta nei trapianti da animale a essere umano perché ha dato il via per altre future nuove sperimentazioni dimostrando che la delezione xenoantigenica dell’epitopo oligosaccaridico alfa – Gal presente nel rene del maiale, noto per provocare il rigetto iperacuto negli xenotrapianti, può essere utilizzata efficacemente (Gal- knock-out) per bloccare le barriere immunologiche all’applicazione clinica di questo tipo di trapianto, eliminando le lunghe liste d’attesa per tutte quelle persone che hanno bisogno di un trapianto per sopravvivere e ritornare ad una vita normale.
breve storia degli xenotrapianti
Nel XIX secolo si praticarono innesti di pelle di pecora sull’uomo per curare le ferite; agli inizi del XX secolo fu fatta la dimostrazione da parte di Alexis Carrel (Premio Nobel per la medicina nel 1912) della possibilità di trapiantare con successo il rene di un cane in un nuovo ospite mentre negli anni venti trapianti di gonadi di babbuini in pazienti di una certa età furono eseguiti dal chirurgo e sessuologo russo naturalizzato francese Serge Voronoff (Sergej Abramovič Voronov; Voronež, 10luglio 1866 – Losanna, 3settembre 1951).
gli xenotrapianti nella seconda metà del novecento

Una ripresa di questo tipo di trapianto, avvenne solo tra gli anni ’60 e gli anni ’70 del XX secolo con alcuni trapianti di rene di scimpanzé effettuati negli esseri umani mentre il primo trapianto di cuore di uno scimpanzé in un uomo sopravvissuto per circa un’ora si ebbe nel 1964 ad opera di James D. Hardy (Birmingham, 14maggio 1918 – Newala, 19febbraio 2003), uno dei più famosi chirurghi di quel periodo, ricordato anche come autore del primo trapianto di polmoni nell’uomo.
Un altro caso molto noto alla stampa fu lo xenotrapianto effettuato dal cardiochirurgo statunitense Leonard Lee Bailey su Baby Fae, nel 1984, una neonata per la quale era stato autorizzato il trapianto di un cuore di un babbuino per provare a darle una speranza, in quanto nata prematura con una grave malformazione cardiaca.
BABY FAE

Questo trapianto le permise di sopravvivere per ben 21 giorni dopo l’operazione, il periodo più lungo per questo tipo di trapianto ma che però a livello etico fece scatenare diverse polemiche.
Con il passare degli anni, l’interesse per gli xenotrapianti è venuto sempre meno a causa dei molti insuccessi dovuti alla compatibilità biologica cioè a quelle differenze genetiche che sono in grado di indurre un rigetto immediato da anticorpi preformati e a delle infezioni che hanno portato ad escludere le scimmie.
L’ARRIVO DI NUOVE TECNOLOGIE

Tuttavia, in questi ultimi dieci anni per ovviare alla disponibilità di organi, la ricerca ha ricominciato a guardare gli animali come un possibile nuovo serbatoio da cui attingere.
Questo ritorno di interesse è legato soprattutto alle recenti innovazioni tecnologiche che sono cambiate ed evolute come la transgenesi, modificando il patrimonio genetico dell’animale mediante inserimento di geni di provenienza umana, o più recentemente con l’editing genomico CRISPR, la cui scoperta è stata premiata con il Nobel per la chimica nel 2020, mediato da nucleasi ingegnerizzate come CRISPR/Cas 9 in grado di accendere (knock.in) o spegnere (knock-out) un gene, come ad esempio il gene responsabile dello xeno-antigene (-Gal) sulle cellule endoteliali renali del suino per diminuire la reazione di rigetto.
IL RIGETTO NEL RENE DEL MAIALE
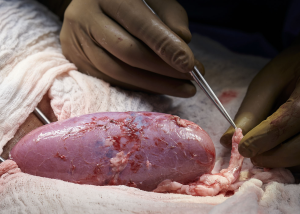
Infatti, il rene del maiale è ricco di alfa – Gal (galattosio- alfa 1-3 galattosio), un epitopo espresso sulla superficie di glicolipidi e glicoproteine dell’endotelio vascolare e, affinché tale epitopo sia sintetizzato, è necessaria l’espressione di un gene che codifica per un enzima, il 3-galattosil transferasi, che partecipa alla sintesi dei carboidrati e delle glicoproteine catalizzando il trasferimento del galattosio dall’UDP – galattosio all’N-acetilglucosammina per formare N- acetil lattosammina.
Primati compresi gli esseri umani, a causa dell’assenza di tale gene nel loro patrimonio genetico, invece, non sintetizzano l’epitopo alpha-gal su glicolipidi e glicoproteine e pertanto il loro sistema immunitario lo riconosce come estraneo producendo anticorpi naturali anti- -gal di tipo IgM e IgG xenoreattivi che portano al rigetto immediato dell’organo dopo il trapianto.
organi candidati ai trapianti
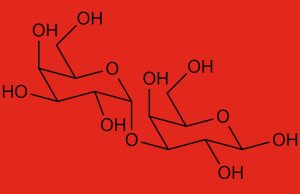
Grazie a CRISPR , correttore del DNA, si è compreso che i maiali possono essere considerati i migliori candidati per i trapianti, specialmente per la loro anatomia simile a quella umana e per il loro ciclo di allevamento più breve rispetto ai primati, per affrontare la carenza di organi.
CRISPR è l’acronimo di “Clustered Regularly Interspaced Short Palindromic Repeats”, ossia sequenze geniche che si ripetono ad intervalli regolari. A questa tecnologia di editing genomico sono associati dei geni Cas (CRISPR associated, da cui deriva “CRISPR /Cas9”) che codificano enzimi che sono capaci di tagliare il DNA che non viene tagliato in modo casuale ma in un punto ben preciso grazie alla presenza di un RNA guida o gRNA.
CRISPR /Cas9

Il sistema è stato originariamente scoperto nei batteri, nei quali agisce come arma di difesa contro i virus – un po’ come avviene per il sistema immunitario umano – e funziona in maniera molto semplice ma con grande efficienza.
Come nel caso della terapia genica, anche la strategia di editing basata su CRISPR può essere somministrata in vivo (direttamente nell’organismo) o ex vivo (all’esterno, su cellule vive prelevate dell’organismo).
un gene knock-out contro il rigetto iperacuto
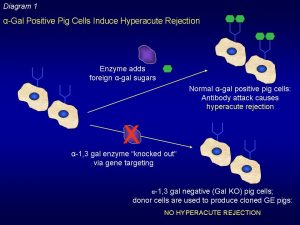
Nello xenotrapianto effettuato dal Dr. Montgomery, il rene suino, trapiantato a puro scopo di ricerca per ridurre il rischio di rigetto umorale immediato, ha ricevuto il gene knock-out dell’unico gene che produce l’α-Gal (Gal knock-out) per mezzo della tecnologia CRISPR, un intervento di precisione che si basa sull’impiego di una proteina della classe delle nucleasi, Cas 9, una sorta di forbice molecolare in grado, attraverso opportuni accorgimenti, di eliminare sequenze di DNA dannose, impedendo al sistema immunitario del donatore di scatenare la forte reazione che porta al rigetto iperacuto.
Questo primo esperimento di editing genomico potrebbe rappresentare una soluzione a breve termine per i pazienti in lista d’attesa fino a quando non sarà disponibile un rene umano, o come trapianto permanente.
Articolo del prof. Sergio Barocci
riferimenti:
- “Pig parts will soon be used for liver, lung and heart transplants: NYU doc says“, By Natalie O’Neill (October 21, 2021)
- https://biomedicalcue.it/riuscito-trapianto-rene-maiale-essere-umano/34148/
- https://it.wikipedia.org/wiki/James_D._Hardy
- https://it.wikipedia.org/wiki/Serge_Voronoff
- https://it.wikipedia.org/wiki/Emmanuelle_Charpentier
- https://it.wikipedia.org/wiki/Jennifer_Doudna
- “Progress in Xenotransplantation Opens Door to New Supply of Critically Needed Organs“, 21 ottobre 2021
- “A Big Step Forward In Solving The Organ Shortage“, di William A. Haseltine (pubblicato su Forbes il 1 novembre 2021
- https://en.wikipedia.org/wiki/Galactose-alpha-1,3-galactose
- https://it.wikipedia.org/wiki/CRISPR
- https://www.nytimes.com/2021/10/19/health/kidney-transplant-pig-human.html
- https://www.futuroprossimo.it/2021/10/rene-di-maiale-geneticamente-modificato-trapiantato-in-un-paziente-umano/
- “US surgeons test pig kidney transplant in a human“, By Michelle Roberts, BBC News online. Published 21 October 2021
- https://www.revivicor.com/technology.html