Breve storia del molnupiravir, il primo antivirale orale per il Covid-19

Il suo nome commerciale è Lagevrio, ed è stato approvato il 4novembre 2021 dall’ente regolatorio del farmaco inglese MHRA (Medicines and Healthcare products Regulatory Agency) come farmaco orale “sicuro ed efficace nel ridurre il rischio di ospedalizzazione e morte nelle persone affette da COVID-19 da lieve a moderato. … Sulla base dei dati degli studi clinici, Lagevrio è più efficace se assunto durante le prime fasi dell’infezione e quindi l’MHRA ne raccomanda l’uso il prima possibile dopo un test COVID-19 positivo ed entro cinque giorni dall’insorgenza dei sintomi”.
EFFICACE AL 50%
Continua il comunicato stampa dell’MHRA:
“Molnupiravir è stato autorizzato per l’uso in persone che hanno COVID-19 da lieve a moderato e almeno un fattore di rischio per lo sviluppo di malattie gravi. Tali fattori di rischio includono obesità, età avanzata (>60 anni), diabete mellito o malattie cardiache. …
Negli studi clinici, Lagevrio si è rivelato efficace nel ridurre del 50% il rischio di ospedalizzazione o morte per gli adulti non ospedalizzati a rischio con COVID-19 da lieve a moderato”.
BREVE STORIA
Il principio attivo del Lagevrio è “Molnupiravir” (codici di sviluppo MK-4482 e EIDD-2801). Esso è un farmaco antivirale che è stato sviluppato per il trattamento dell’influenza da scienziati della “Emory University” di Atlanta (ed altri Istituti come la “University of Washington” ed il “Paul-Ehrlich-Institute“) nel 2018 .
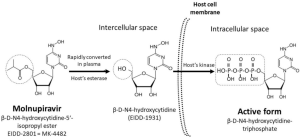
Molnupiravir è un profarmaco del derivato nucleosidico sintetico N4-idrossicitidina, ed esplica la sua azione antivirale attraverso “l’introduzione di errori di copiatura durante la replicazione dell’RNA virale“.
UN PROFARMACO
Beta-d-N4-hydroxycytidine (Emory Institute for Drug Development [EIDD]-1931) è un analogo ribonucleosidico biodisponibile per via orale ed ha attività ad ampio spettro contro numerosi virus ad RNA in modelli animali.
Molnupiravir, β-d-N4-idrossicitidina-5′-isopropil estere (EIDD-2801), è un profarmaco della β-d-N4-idrossicitidina (EIDD-1931) e viene rapidamente convertito in EIDD-1931 nel plasma dal esterasi dell’ospite. Dopo essere entrato nelle cellule ospiti, EIDD-1931 viene trasformato intracellularmente nella sua forma attiva, -d-N4-idrossicitidina-trifosfato (chiamato anche EIDD-1931 5′-trifosfato o NHC-TP), che inibisce la replicazione virale attraverso la sua incorporazione nel genoma virale, un effetto chiamato “catastrofe di errore virale“.
catastrofe di errore virale
EIDD-1931 può esistere in due forme. In una forma, imita la citidina, con un singolo legame tra il carbonio e il gruppo N-OH. Nella sua altra forma, che imita l’uridina, ha un’ossima con un doppio legame tra il carbonio e il gruppo N-OH. Queste due forme sono note come tautomeri e il passaggio tra di esse causa la mancata corrispondenza durante la trascrizione. Quindi, quando il virus cresce in presenza di EIDD-1931, la sua RNA polimerasi RNA-dipendente legge il composto come uridina invece di citidina e quindi mette un’adenosina dove dovrebbe inserire una guanosina. Questa lettura errata crea un numero enorme di mutazioni nel genoma virale e i virus copiati non possono funzionare.
In un modello murino umanizzato (cioè topi con polmone umanizzato), la somministrazione terapeutica e profilattica di molnupiravir ha notevolmente ridotto la replicazione in vivo e la patogenesi di SARS-CoV-2 nei pneumociti di tipo 2.
DALLA EMORY UNIVERSITY ALLA MERCK & CO.
Molnupiravir è stato sviluppato dalla società di innovazione farmaceutica della Emory University, la “Drug Innovation Ventures at Emory” (DRIVE). Nel 2014, DRIVE aveva avviato un progetto di screening finanziato dalla Defense Threat Reduction Agency per trovare un farmaco antivirale mirato al virus dell’encefalite equina venezuelana (VEEV), che ha portato alla scoperta dell’EIDD-1931. Quando è stato trasformato nel profarmaco EIDD-2801 (molnupiravir), il composto ha mostrato anche attività contro altri virus a RNA tra cui influenza, Ebola, chikungunya e vari coronavirus.
EIDD-2881 è stato quindi acquisito dalla società “Ridgeback Biotherapeutics” con sede a Miami, che in seguito ha collaborato con il colosso farmaceutico statunitense Merck & Co. per studiare ulteriormente il farmaco. Gli studi di tollerabilità e sicurezza hanno dato buoni risultati.
come il martello di un dio pagano

Il nome del farmaco è stato ispirato da quello del martello di Thor, Mjölnir . L’idea è che il farmaco possa abbattere il virus, come un potente colpo del dio del tuono. Nel trial di fase 3 di ottobre 2021, Dopo 29 giorni di follow-up, 53 dei 377 partecipanti che hanno ricevuto il placebo sono stati ricoverati in ospedale con COVID-19 e otto di quei partecipanti sono morti. Tra coloro che hanno ricevuto il farmaco, solo 28 su 385 sono stati ricoverati in ospedale e nessuno di quei pazienti è morto. In altre parole, il 7,3 percento dei pazienti trattati con il farmaco è stato ricoverato in ospedale o è morto rispetto al 14,1 percento nel gruppo placebo.
I dati sulla sicurezza sono stati ugualmente promettenti, con i partecipanti che hanno riportato un numero simile di eventi avversi correlati al farmaco tra il gruppo placebo rispetto al gruppo farmaco (rispettivamente 11% e 12%). Circa il 3,4% delle persone nel gruppo placebo ha abbandonato lo studio a causa di eventi avversi, mentre solo l’1,3% nel gruppo farmaco.
la ricerca
Richard Plemper, professore alla “Georgia State University“, è stato il principale investigatore di una sovvenzione del National Institutes of Health (NIH) per esplorare l’uso di molnupiravir contro l’influenza. Alla fine del 2019, l’Istituto nazionale per le allergie e le malattie infettive ha approvato lo spostamento di molnupiravir negli studi clinici di fase I per l’influenza.
Nel marzo 2020, il team di ricerca si è concentrato sullo studio della SARS-CoV-2 e ha utilizzato con successo il farmaco per trattare le cellule umane infettate dal nuovo coronavirus. Il gruppo di Plemper ha pubblicato sulla rivista “Nature Microbiology” la prima dimostrazione che molnupiravir è attivo per via orale contro SARS-CoV-2 in un modello animale e ha stabilito una prova del concetto che il trattamento sopprime completamente la trasmissione del virus ai contatti non trattati entro 24 ore.
DRIVE ha quindi concesso in licenza molnupiravir per studi clinici sull’uomo alla società Ridgeback Biotherapeutics con sede a Miami, che in seguito ha collaborato con Merck & Co. per sviluppare ulteriormente il farmaco. Nel settembre 2021, Merck ha firmato un accordo di licenza volontaria con il “Medicines Patent Pool” (MPP) che consente a MPP di concedere in sublicenza molnupiravir e fornire il farmaco orale COVID-19 a 105 paesi a basso e medio reddito.
riferimenti:
- Comunicato Stampa: “Primo antivirale orale per COVID-19, Lagevrio (molnupiravir), approvato da MHRA“
- https://en.wikipedia.org/wiki/Molnupiravir
- “Characterization of orally efficacious influenza drug with high resistance barrier in ferrets and human airway epithelia“, di Mart Toots e colleghi; Sci Transl Med. 2019 October 23; 11(515): . doi:10.1126/scitranslmed.aax5866.
- “Molnupiravir—A Novel Oral Anti-SARS-CoV-2 Agent” di by Ching-Chi Lee, Chih-Chia Hsieh and Wen-Chien Ko – Antibiotics 2021, 10(11), 1294; https://doi.org/10.3390/antibiotics10111294
- “Human Safety, Tolerability, and Pharmacokinetics of Molnupiravir, a Novel Broad-Spectrum Oral Antiviral Agent with Activity against SARS-CoV-2“, di Wendy P. Painter e colleghi
- https://en.wikipedia.org/wiki/Error_catastrophe
- “An emerging antiviral takes aim at COVID-19“, by Bethany Halford – May 5, 2020
- “Meet molnupiravir, Merck’s Thor-inspired pill that hammers COVID” di Beth Mole
- “Oral Drug Tested at Georgia State Recommended for Emergency Use Authorization to Treat COVID-19“; OCTOBER 1, 2021
- “Therapeutically Administered Ribonucleoside Analogue MK-4482/EIDD-2801 Blocks SARS-CoV-2 Transmission in Ferrets“, di Robert M. Cox, Josef D. Wolf and Richard K. Plemper1 – Nat Microbiol. 2021 Jan; 6(1): 11–18.
Published online 2020 Dec 3. doi: 10.1038/s41564-020-00835-2 - Comunicato stampa del 1 ottobre 2021: “Merck and Ridgeback’s Investigational Oral Antiviral Molnupiravir Reduced the Risk of Hospitalization or Death by Approximately 50 Percent Compared to Placebo for Patients with Mild or Moderate COVID-19 in Positive Interim Analysis of Phase 3 Study“