HANS ADOLF KREBS
- Articolo del prof. Sergio Barocci – Università di Genova per la terza età
UN BIOCHIMICO INGLESE DI ORIGINE TEDESCA
Hans Adolf Krebs, biochimico inglese di origine tedesca, nacque a Hildesheim in Germania nel 1900 da Alma e Georg Krebs (chirurgo otorinolaringoiatra)( Figura 1).

Dapprima frequentò le scuole della sua città, in seguito studiò Medicina presso diversi atenei (Università di Gottinga, Friburgo e Berlino), dal 1918 al 1923. Nel 1925 conseguì la laurea presso l’Università di Amburgo, poi fece ritorno a Berlino per un anno dove si specializzò in chimica, e dal 1926 al 1930 divenne assistente del biochimico Otto Heinrich Warburg (premio Nobel per la Medicina nel 1931 per le sue ricerche sugli enzimi respiratori) al Kaiser Wilhelm Institut für Biologie di Berlino-Dahlem.
Nel 1930 si dedicò all’attività di medico, ma nel 1933, in seguito alle discriminazioni razziali in Germania in quanto ebreo per parte di madre, gli fu vietato di praticare la medicina e per questo motivo dovette emigrare in Inghilterra a Cambridge dove lavorò presso il Dipartimento di Biochimica alle dipendenze di Sir Frederick Gowland Hopkins (1861 – 1947) e poi a Sheffield dove insegnò farmacologia e biochimica.
studiando reazioni metaboliche

Nel 1954 ottenne la cattedra di biochimica all’Università di Oxford (Figura 2).
I suoi studi furono dedicati alla comprensione di numerose reazioni metaboliche cioè di quei processi del metabolismo con cui le cellule viventi trasformano energia. Nel 1932 fece delle ricerche principalmente su vari aspetti del metabolismo intermedio come la sintesi dell’urea nel fegato dei mammiferi, la sintesi di acido urico e basi puriniche nei volatili, le fasi intermedie di ossidazione di prodotti alimentari, il meccanismo di trasporto attivo di elettroliti e le relazioni tra respirazione cellulare e la formazione di adenosina trifosfato o ATP.
IL CICLO degli acidi tricarbossilici
 Nel 1937 dimostrò l’esistenza di un complesso ciclo di trasformazioni biochimiche a cui va incontro, all’interno dei mitocondrî, l’acido piruvico prodotto nel citoplasma durante la glicolisi.
Nel 1937 dimostrò l’esistenza di un complesso ciclo di trasformazioni biochimiche a cui va incontro, all’interno dei mitocondrî, l’acido piruvico prodotto nel citoplasma durante la glicolisi.
Questo insieme di reazioni che coinvolgono elementi chiave delle catene dei processi chimici che presiedono al metabolismo viene chiamato oggi ciclo di Krebs o ciclo degli acidi tricarbossilici o ancora ciclo dell’acido citrico – responsabile della degradazione dei carboidrati, dei grassi e delle proteine in CO2 e H2O con la formazione di energia chimica. L’importanza fondamentale di questo ciclo nel metabolismo energetico cellulare consiste infatti nel fornire gli equivalenti riducenti necessarî per la sintesi di ATP attraverso la fosforilazione ossidativa.
premio Nobel ed altri riconoscimenti

Per questa sua scoperta egli ricevette nel 1953 insieme al biochimico tedesco Fritz Albert Lipmann (scoperta del Coenzima A come intermediario del metabolismo) il premio Nobel per la Medicina. Nel discorso di accettazione del Nobel Hans Adolf Krebs ricordò Otto Heinrich Warburg come suo ispiratore e maestro.
Tra le sue numerose pubblicazioni da menzionare in particolare è quella del 1957, in collaborazione con H. L. Kornberg sulle trasformazioni energetiche negli esseri viventi. Nel 1954 ricevette la “Royal Medal” della Royal Society, e nel 1958 la Medaglia d’Oro della Società olandese per la Fisica, Medicina e Chirurgia. Venne anche nominato cavaliere nel 1958. Conseguì inoltre le lauree honoris causa dalle Università di Chicago, Freiburg-im-Breisgau, Parigi, Glasgow, Londra, Sheffield, Leicester, Berlino (Humboldt University), e Gerusalemme.
rifiutato da ‘nature‘

Hans Adolf Krebs viene oggi considerato uno principali biologi che maggiormente hanno marcato il progresso di conoscenze sui processi delle cellule viventi. Un interessante aneddoto sulla sua vita è stato quello relativo alla pubblicazione del suo lavoro fondamentale del 1937.
La pubblicazione fu addirittura rifiutata dalla rivista Nature (1) che, ricevuto l’articolo in cui Krebs descriveva il ciclo metabolico della biochimica delle cellule, lo respinse peraltro senza motivazione. Tale lavoro venne pubblicato, invece, nel 1937 senza esitazioni da una meno blasonata rivista, “Enzymologia“ (2), due mesi dopo il rifiuto di Nature.
A parziale discolpa, un editoriale comparso nell’ottobre 2003 su Nature affermerà che la rivista aveva chiesto a Krebs di aspettare qualche settimana per la pubblicazione del loro lavoro, a causa della lunga coda di articoli da smaltire.
La scoperta del ciclo di Krebs
Come tutte le grandi scoperte, anche quella del ciclo di Krebs non nasce dal nulla ma da una solida tradizione di indagini biochimiche e nello stesso tempo non matura, ma in una forma ancora incompleta e suscettibile di perfezionamenti e ulteriori chiarimenti.
La pubblicazione ritenuta in genere fondamentale portò il seguente titolo “The role of citric acid in intermediate metabolism in animal tissues” di H.A. Krebs ed il post-laureato William Arthur Johnson, nato del 1913, del Dipartimento di Farmacologia presso l’Università di Sheffield.
Il ciclo di Krebs
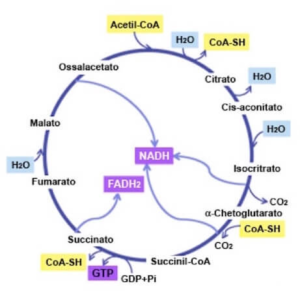
Il ciclo di Krebs (Figura 3) (8 – 11) avviene nei mitocondri delle cellule eucariotiche e nel citoplasma delle cellule procariotiche. I catabolismi glucidico e lipidico (attraverso la glicolisi e la beta-ossidazione), producono acetil-CoA, un gruppo acetile legato al coenzima A.
L’acetil-CoA costituisce il principale substrato del ciclo. Il suo ingresso consiste in una condensazione con ossalacetato, a generare citrato. Al termine del ciclo stesso, i due atomi di carbonio immessi dall’acetil-CoA verranno ossidati in due molecole di CO2, rigenerando nuovamente ossalacetato in grado di condensare con acetil-CoA. La produzione rilevante dal punto di vista energetico, tuttavia, è quella di una molecola di GTP (immediatamente utilizzata per rigenerare una molecola di ATP), di tre molecole di NADH ed una di FADH2.
Produzione di Energia
I cofattori ridotti (NADH e FADH2), si comportano come intermedi ossido/riduttivi. Quando ridotti, essi sono in grado di trasportare elettroni ad energia relativamente alta (sottratti ai substrati ossidati ad esempio nella glicolisi o nello stesso ciclo di Krebs) fino alla catena respiratoria mitocondriale. Presso tale catena, essi vengono riossidati (a NAD+ e FAD) e cedono gli elettroni alla catena stessa, che sarà così in grado di rigenerare molecole di ATP da ADP.
La reazione netta è la seguente:
Acetil-CoA + 3 NAD + FAD + ADP + Pi → CoA + 3 NADH + H+ + FADH2 + ATP + 2 CO2
L’energia che si ricava dalla completa demolizione di una molecola di glucosio attraverso i tre diversi stadi della respirazione cellulare (glicolisi, ciclo di Krebs e catena di trasporto di elettroni), è idealmente di 36 molecole di ATP.
PRODUZIONE DI ATP
In realtà sono 38 le molecole nette di ATP ad essere prodotte ma due di esse vengono consumate per trasportare (tramite trasporto attivo) dal citoplasma alla matrice mitocondriale le due molecole di NADH prodotte nella glicolisi.
Il ciclo di Krebs è regolato da otto tappe con diversi tipi di reazioni mediate da almeno un enzima.
1° tappa: ossalacetato condensa con l’acetil CoA per formare citrato
Questa reazione che è una condensazione aldolica è seguita da un idrolisi ed è catalizzata dalla citrato sintasi (3): l’ossalacetato prima condensa con l’acetil CoA formando citril CoA che poi viene idrolizzato a citrato e CoA. L’idrolisi del citril CoA spinge la reazione complessiva nella direzione della sintesi del citrato.
2° tappa: il citrato è isomerizzato a isocitrato
L’isomerizzazione del citrato avviene mediante una deidratazione seguita da una idratazione. Il risultato è uno scambio di posizione tra un atomo di H e un gruppo OH. L’enzima che catalizza entrambe le tappe è l’aconitasi (4,12,13), in quanto il cis- aconitato è un intermedio della reazione. L’aconitasi è una proteina conosciuta come proteine ferro – zolfo o come ferro proteine non eminiche in quanto i suoi atomi di ferro non sono legati a gruppi eme.
3° tappa: l’isocitrato è ossidato e decarbossilato ad α-chetoglutarato
La decabossilazione ossidativa dell’isocitrato è catalizzata dalla isocitrato-deidrogenasi (14 -18). L’intermedio di questa reazione è l’ossalsuccinato, un β – chetoacido instabile. Infatti, quando questo composto è legato all’enzima perde CO2 e forma α-chetoglutarato.
4° tappa: il succinil CoA si forma per decarbossilazione ossidativa dell’ α- chetoglutarato.
La conversione dell’isocitrato in α-chetoglutarato è seguita da una seconda reazione di decarbossilazione ossidativa, la formazione del succinil CoA dall’ α-chetoglutarato. La reazione è catalizzata dal complesso dell’α-chetoglutarato deidrogenasi, una struttura organizzata costituita da tre enzimi, con un meccanismo simile a quello della conversione del piruvato in acetil Co A.
5° tappa: dal succinil CoA si forma un legame fosforico ad alta energia
Il legame tioestere tra il succinato e il CoA è un legame ad alta energia. La scissione del legame tioestere del succinil CoA è accoppiata alla fosforilazione della guanosina difosfato (GDP). La reazione è reversibile ed è catalizzata dalla succinil CoA sintetasi (5). Si tratta dell’unica tappa del ciclo di Krebs in cui si ha la produzione diretta di un legame fosforico ad alta energia. Il GTP viene utilizzato come donatore di gruppi fosforici nella sintesi proteica. In alternativa, il gruppo fosforico in posizione γ può essere trasferito facilmente dall’ ADP per formare ATP in una reazione catalizzata dalla nucleoside difosfochinasi.
6°, 7° e 8° tappa: rigenerazione dell’ossalacetato per ossidazione del succinato

Il succinato viene convertito in ossalacetato in tre tappe: una ossidazione, una idratazione e una seconda reazione di ossidazione. L’ossalacetato è, pertanto, rigenerato e utilizzabile per un altro giro del ciclo, mentre l’energia è conservata sotto forma di FADH2 e di NADH.
Il succinato è ossidato a fumarato dalla succinato deidrogenasi (6). L’accettore di atomi di idrogeno è il FAD anziché il NAD+ che viene, invece, utilizzato in altre tre tappe ossido – riduttive del ciclo. Il FAD è l’accettore di atomi di idrogeno in questa reazione in quanto la variazione di energia libera è troppo piccola per ridurre il NAD+. Il FAD è l’accettore di elettroni in quasi tutte le reazioni di ossidazione in cui vengono rimossi due atomi di idrogeno dal substrato. Nella succinato deidrogenasi l’anello isoallossazinico del FAD è legato in maniera covalente alla catena laterale di un residuo di istidina dell’enzima, chiamato E-FAD. La succinato deidrogenasi come l’aconitasi è anch’essa una proteina ferro – zolfo non eminica ma che differisce dall’aconitasi per contenere tre diversi tipi diversi di centri ferro – zolfo.
La succinato deidrogenasi, inoltre, a differenza degli altri enzimi del ciclo è parte integrale della membrana interna dei mitocondri. Per questo motivo, la succinato deidrogenasi è direttamente legata alla catena di trasporto degli elettroni. Il FADH2 prodotto dall’ossidazione del succinato non si dissocia dall’enzima come accade invece al NADH prodotto in altre reazioni di ossido – riduzione. Due elettroni sono trasferiti dal FADH2 direttamente ai centri ferro – zolfo dell’enzima e l’accettore finale di questi elettroni è l’ossigeno molecolare.

La tappa successiva del ciclo di Krebs è l’idratazione del fumarato per formare il malato. La fumarasi (19) catalizza l’addizione stereospecifica di H e di OH. Il gruppo OH si lega solo da un lato del doppio legame del fumarato formando l’isomero L del malato.
Infine, il malato viene ossidato ad ossalacetato. Questa reazione è catalizzata dalla malato deidrogenasi (7,20) e l’accettore di atomi di idrogeno è ancora il NAD+.
Bilancio energetico globale
Il ciclo di Krebs di per sé non produce energia liberamente utilizzabile, se non nella reazione tra succinil-CoA e succinato dove si assiste alla formazione di GTP facilmente scambiabile in ATP.
Il ciclo, però, fornisce due tipi di cofattori ridotti capaci di trasportare elettroni ad alta energia ovvero il NADH ed il FADH2 che possono essere agilmente utilizzati nella catena respiratoria.
Tenendo conto che per ogni molecola di NADH e FADH2, possono essere sintetizzate circa 2,5 molecole di ATP e che una molecola di ATP è facilmente sintetizzabile da GTP nel ciclo di Krebs vengono formate un numero di molecole sufficienti per sintetizzare ben 11 molecole di ATP.
Interazioni tra ciclo di Krebs ed altre vie metaboliche
Il ciclo di Krebs occupa una posizione centrale nel metabolismo dei viventi, ricoprendo un ruolo chiave soprattutto nelle vie cataboliche (Figura 4).
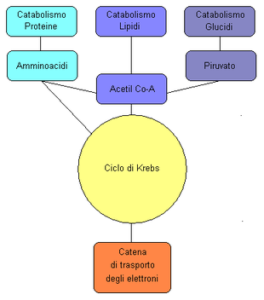
Il ciclo di Krebs è infatti il 2° stadio del catabolismo dei carboidrati. La glicolisi degrada il glucosio (ed altre molecole a sei atomi di carbonio) in piruvato (un α-chetoacido contenente tre atomi di carbonio).
Negli eucarioti il piruvato viene trasferito dal citoplasma (sede della glicolisi) nei mitocondri dove perde un atomo di carbonio e viene convertito in acetil-CoA dalla piruvato deidrogenasi (decarbossilazione ossidativa del piruvato).
All’interno del mitocondrio, l’acetil-CoA può entrare nel ciclo di Krebs, come precedentemente descritto.
Per quanto riguarda le proteine, esse vengono degradate con meccanismi detti di proteolisi attraverso enzimi detti proteasi, che le frammentano nei costituenti fondamentali: gli amminoacidi.
Amminoacidi e lipidi come fonte di energia
Alcuni amminoacidi possono costituire una fonte di energia, poiché sono convertibili in alcuni intermedi del ciclo stesso (ad esempio aspartato, valina ed isoleucina). Altri, convertibili in molecole glucidiche, possono entrare nel ciclo passando per le vie cataboliche tipiche dei glucidi (ad esempio l’alanina, convertibile in piruvato).
Nel catabolismo lipidico, i trigliceridi sono idrolizzati da enzimi detti lipasi per formare acidi grassi e glicerolo.
Negli organismi superiori, il glicerolo può entrare nella glicolisi a livello epatico o essere trasformato in glucosio attraverso il diidrossiacetone fosfato e la gliceraldeide-3-fosfato seguendo la via metabolica della gluconeogenesi. In molti tessuti, specialmente nel cuore, gli acidi grassi sono degradati attraverso un processo noto come beta-ossidazione, che produce acetil-CoA, a sua volta internalizzato nel ciclo di Krebs.
La beta-ossidazione può anche generare propionil-CoA, che a sua volta può essere reimmesso nella via gluconeogenetica epatica a generare glucosio.
Ciclo di Krebs e fosforilazione ossidativa
Il ciclo di Krebs è sempre seguito dalla fosforilazione ossidativa, una catena di trasporto di elettroni. L’una non avrebbe senso senza l’altra in quanto l’ATP e il GTP quest’ultimo prodotto dal ciclo è scarso e la produzione di NADH e FADH2 porterebbe ad un ambiente mitocondriale eccessivamente ridotto, mentre la sola catena respiratoria necessiterebbe di una fonte di cofattori ridotti pena l’ossidazione dell’ambiente.
Questa respirazione cellulare estrae energia da NADH e FADH2, ricreando NAD+ e FAD, permettendo in tal modo al ciclo di continuare. Il ciclo di Krebs non usa ossigeno, che è invece utilizzato nella fosforilazione ossidativa.
INTERMEDI DEL CICLO DI KREBS
Gli intermedi del ciclo di Krebs sono implicati in numerosi altre vie metaboliche. Le vie metaboliche, in maniera sommaria in cui vengono coinvolti i metaboliti del ciclo di Krebs:
1. Acetil CoA: a) beta ossidazione; b) biosintesi degli acidi grassi; c) degradazione della lisina; d) degradazione di valina ed isoleucina; e) metabolismo della fenilalanina.
2. α- Chetoglutarato: a) biosintesi della lisina; b) metabolismo dell’acido ascorbico; c) metabolismo del glutammato.
3. Succinil CoA: a) metabolismo del propanoato; b) sintesi delle porfirine; c) degradazione di leucina ed isoleucina; d) metabolismo della fenilalanina.
4. Succinato: a) metabolismo del butanoato; b) metabolismo della tirosina.
5. Fumarato: a) ciclo dell’urea; b) metabolismo dell’arginina e della prolina; c) metabolismo della tirosina.
6. Ossalacetato: a) metabolismo del gliossilato; b) metabolismo del glutammato e dell’aspartato; c) gluconeogenesi.
Bibliografia:
-
-
-
Brendan Borrell. “Nature rejects Krebs’s paper, 1937“. The Scientist 24 (3), 88.
-
Krebs, H. A., and Johnson, W. A. (1937) “The role of citric acid in intermediate metabolism in animal tissues” . Enzymologia 4, 148-156.
-
Usher, J. Remington, P. Martin, G. Drueckhammer, (1994). ”A very short hydrogen bond provides only moderate stabilization of an enzyme-inhibitor complex of citrate synthase”. Biochemistry 33, S. 7753-7759.
-
H. Lauble, Stout C.D. (1995) . “Steric and conformational features of the aconitase mechanis” Proteins 22, S. 1-11, 1995
-
Fraser, M.E., James, M.N., Bridger, W.A., Wolodko, W.T. (2000) “Phosphorylated and dephosphorylated structures of pig heart, GTP-specific succinyl-CoA synthetase”. J.Mol.Biol. 299, 1325-1339.
-
V. Yankovskaya, R. Horsefield, S. Tornroth, C. Luna-Chavez, H. Miyoshi, C. Leger, B. Byrne, G. Cecchini, S. Iwata (2003) “Architecture of succinate dehydrogenase and reactive oxygen species generation “ . Science 299, S. 700-704.
-
Weaver, T., Lees, M., Zaitsev, V., Zaitseva, I., Duke, E., Lindley, P., McSweeny, S., Svensson, A., Keruchenko, J., Keruchenko, I., Gladilin, K., Banaszak, L.(1998) ” Crystal structures of native and recombinant yeast fumarase”. J.Mol.Biol. v280 pp.431-442.
-
V. Donald, Voet Judith G. e Pratt Charlotte W., Fondamenti di biochimica, Bologna, Zanichelli, 2001
-
Nelson David L. e Cox Michael M. Principi di biochimica, Bologna, Zanichelli, 2002
-
Berg Jeremy M., Tymoczko John L. e Stryer Lubert .Biochimica, Bologna, Zanichelli, 2003
-
Garret R.H. , Grisham C.M. Principi di Biochimica Padova, Ed. PICCIN, 2004.
-
Morrison, J.F. “The purification of aconitase“. Biochem. J. 56 1954. 99–105.
-
Lauble, H., Kennedy, M.C., Beinert, H. and Stout, C.D. 1954 . “Crystal structures of aconitase with trans-aconitate and nitrocitrate bound.” J. Mol. Biol. 237, 437–451.
-
Hathaway, J.A. and Atkinson, D.E. 1963. “The effect of adenylic acid on yeast nicotinamide adenine dinucleotide isocitrate dehydrogenase, a possible metabolic control mechanism “.J. Biol. Chem. 238, 2875–2881.
-
Kornberg, A. and Pricer, W.E. 1951 “Di- and triphosphopyridine nucleotide isocitric dehydrogenase in yeast “. J. Biol. Chem. 189 , 123–136.
-
Plaut, G.W.E. and Sung, S.-C. 1954 . “Diphosphopyridine nucleotide isocitric dehydrogenase from animal tissues”. J. Biol. Chem. 207, 305–314.
-
Vickery, H.B. 1962 .”A suggested new nomenclature for the isomers of isocitric acid.” J. Biol. Chem. 237, 1739–1741.
-
Kim, Y.O., Koh, H.J., Kim, S.H., Jo, S.H., Huh, J.W., Jeong, K.S., Lee, I.J., Song, B.J. and Huh, T.L. 1999. “Identification and functional characterization of a novel, tissue-specific NAD+-dependent isocitrate dehydrogenase β subunit isoform.” J. Biol. Chem. 274 , 36866–36875.
-
Kanarek, L. and Hill, R.L. 1964. “The preparation and characterization of fumarase from swine heart muscle.” J. Biol. Chem. 239 , 4202–4206.
-
Guha, A., Englard, S. and Listowsky, I. 1968. “Beef heart malic dehydrogenases.” VII. Reactivity of sulfhydryl groups and conformation of the supernatant enzyme. J. Biol. Chem. 243 , 609–615
-
-





