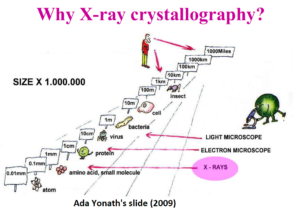
Contributi della cristallografia a raggi X al progresso biomedico
In mineralogia e cristallografia, un cristallo (dal greco κρύσταλλος, krýstallos, ghiaccio) è una struttura solida costituita da atomi, molecole o ioni aventi una disposizione geometricamente regolare, che si ripete indefinitamente nelle tre dimensioni spaziali, detta reticolo cristallino.
La cristallografia (dal greco “krystallos“, “ghiaccio” e “graphein“, “scrivere”) è la scienza che si occupa dello studio dei cristalli. In particolare si occupa della loro formazione, crescita, struttura microscopica, aspetto macroscopico e proprietà fisiche.
La cristallografia a raggi X è la scienza sperimentale che determina la struttura atomica e molecolare di un cristallo, in cui la struttura cristallina provoca la diffrazione di un raggio di raggi X incidente in molte direzioni specifiche.
cristalli e cristallografia

Misurando gli angoli e le intensità di questi raggi diffratti, un cristallografo può produrre un’immagine tridimensionale della densità degli elettroni all’interno del cristallo. Da questa densità elettronica si possono determinare le posizioni medie degli atomi nel cristallo, così come i loro legami chimici, il loro disordine cristallografico e varie altre informazioni.
I cristalli, sebbene a lungo ammirati per la loro regolarità e simmetria, non furono studiati scientificamente fino al XVII secolo. Giovanni Keplero (1571-1630) ipotizzò nella sua opera “Strena seu de Nive Sexangula“ (Sul fiocco di neve a sei angoli, 1611) che la simmetria esagonale dei cristalli dei fiocchi di neve fosse dovuta a un regolare impaccamento di particelle d’acqua sferiche.
Wilhelm Röntgen scoprì i raggi X nel 1895. I fisici erano incerti sulla natura dei raggi X, ma presto sospettarono che fossero onde di radiazione elettromagnetica.
L’idea che i cristalli potessero essere usati come reticolo di diffrazione per i raggi X nacque nel 1912 in una conversazione tra Paul Peter Ewald e Max von Laue nel Giardino Inglese di Monaco di Baviera.
Max von Laue

Il Premio Nobel per la Fisica 1914 fu assegnato a Max von Laue “per la sua scoperta della diffrazione dei raggi X da parte dei cristalli“.
Il Premio Nobel per la Fisica del 1915 venne concesso all’australiano William Henry Bragg e suo figlio William Lawrence Bragg (31marzo 1890 – 1luglio 1971) con la menzione “per i loro servizi nell’analisi della struttura cristallina mediante raggi X“.
Il loro lavoro, negli anni 1912-1914, fondò una nuova branca della scienza della massima importanza e significato, l’analisi della struttura cristallina per mezzo dei raggi X. I loro contributi includevano stabilire la relazione tra la lunghezza d’onda dei raggi X, il suo angolo di incidenza e la distanza tra gli strati atomici all’interno del cristallo, espressa nella cosiddetta “legge di Bragg“, sviluppata dal giovane Lawrence.
CRISTALLOGRAFIA A RAGGI X E BIOLOGIA

La prima struttura a risoluzione atomica ad essere “risolta” (cioè determinata) fu quella del sale da cucina, nel 1914.
Con il miglioramento dei metodi computazionali e sperimentali nei decenni successivi, divenne possibile dedurre posizioni atomiche affidabili per disposizioni bidimensionali e tridimensionali più complicate degli atomi nella cella unitaria. Durante gli anni ’30, questo metodo venne utilizzato per mappare molecole sempre più grandi e complesse.
La cristallografia a raggi X di molecole biologiche decollò con Dorothy Crowfoot Hodgkin, che risolse le strutture del colesterolo (1937), della penicillina (1946) e della vitamina B 12 (1956), per la quale ricevette il Premio Nobel per la Chimica nel 1964 “per le sue determinazioni mediante tecniche a raggi X delle strutture di importanti sostanze biochimiche”. Nel1969, riuscì a risolvere la struttura dell’insulina, su cui lavorava da oltre trent’anni.
cristallografia a raggi x e dna
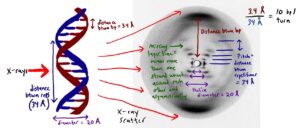
Un contributo fondamentale alla determinazione della struttura tridimensionale a doppia elica arrivò dalla cristallografia a raggi X. Il 25aprile 1953, la prestigiosa rivista Nature pubblicò diversi articoli. Uno si intitolava “Molecular Structure of Nucleic Acids: A Structure for Deoxyribose Nucleic Acid” e i suo autori erano i biofisici J. D. Watson e F. H. C. Crick. Un secondo aveva il titolo “Molecular Structure of Nucleic Acids: Molecular Structure of Deoxypentose Nucleic Acids” e portava la firma di dei cristallografo inglese M. H. F. Wilkins e dei suoi colleghi A. R. Stokes e H. R. Wilson. L’articolo recitava: “gli studi a diffrazione a raggi X qua descritti mostrano che la configurazione molecolare di base (dell’acido nucleico deossipentoso) ha una grande semplicità …“.
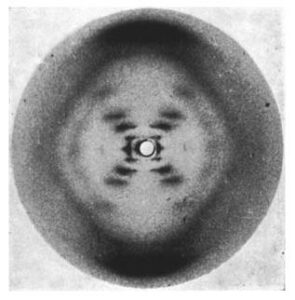
LA FOTO 51
Il terzo, “Molecular Configuration in Sodium Thymonucleate“, portava la firma della ricercatrice Rosalind E. Franklin e del suo collaborate R. G. Gosling. L’articolo conteneva l’analisi di Franklin e Gosling del loro modello di diffrazione dei raggi X di timonucleato o acido desossiribonucleico, noto come DNA.
Rosalind E. Frankin e R. G. Gosling furono coloro che riuscirono ad ottenere, attraverso la cristallografia a raggi X, la celeberrima Foto 51, una delle immagini più iconiche nella storia della Biologia. Franklin e Gosling spiegarono le caratteristiche che osservano nella Foto 51, determinando il raggio di una fibra di DNA e il numero di nucleotidi di DNA per giro dell’elica.
La storia del Premio Nobel per la Fisiologia o la Medicina del 1962 è (tristemente) nota: il premio fu assegnato congiuntamente a Francis Harry Compton Crick, James Dewey Watson e Maurice Hugh Frederick Wilkins “per le loro scoperte riguardanti la struttura molecolare degli acidi nucleici e il suo significato per il trasferimento di informazioni nella materia vivente“. Nel frattempo, Rosalind Elsie Franklin era morta da quattro anni, quasi completamente dimenticata nonostante il suo notevole contributo alla scoperta.
CRISTALLOGRAFIA E PROTEINE

Le strutture cristalline delle proteine (che sono irregolari e centinaia di volte più grandi del colesterolo) iniziarono a essere risolte alla fine degli anni ’50 del novecento, a cominciare dalla struttura della mioglobina del capodoglio, da parte del biochimico e cristallografo inglese John Cowdery Kendrew (Oxford, 24marzo 1917 – Cambridge, 23agosto 1997).
Nel 1959, Max Ferdinand Perutz (Vienna, 19maggio 1914 – Cambridge, 6febbraio 2002), biologo e cristallografo ebreo-austriaco naturalizzato britannico dopo essere scappato dalle persecuzioni naziste, riuscì a determinare la struttura molecolare dell’emoglobina.
NOBEL PER LA MEDICINA E PER LA CHIMICA

Nel 1962, mentre Watson, Crick e Wilkins ricevevano il Premio Nobel per la Medicina, Kendrew e Perutz condividevano il Premio Nobel per la Chimica “per i loro studi sulle strutture delle proteine globulari“.
Perutz aveva iniziato il suo lavoro attraverso raggi X sulle proteine cristalline nel “Laboratorio Cavendish” a Cambridge sotto il professor John Desmond Bernal nel 1937, subito dopo che lui e Dorothy Hodgkin avevano dimostrato che i cristalli proteici possono essere riprodurre schemi di diffrazione di raggi X nitidi, che si estendono alle spaziature dell’ordine di distanze interatomiche.
cristallografia e ribosomi

Più recentemente, nel 2009, il Premio Nobel per la Chimica è stato assegnato alla biochimica e cristallografa israeliana Ada E. Yonath.
Alla fine degli anni ’70, Ada era una giovane ricercatrice presso l’Istituto Weizmann con un progetto ambizioso per far luce su una delle principali questioni in sospeso riguardanti le cellule viventi: il processo di biosintesi delle proteine. A questo scopo cercò di determinare la struttura tridimensionale del ribosoma.
Ella iniziò questi studi in collaborazione con il prof. H. G. Wittmann del “Max Planck Institute for Molecular Genetics” di Berlino, che li sosteneva dal punto di vista accademico e finanziario.
ISPIRAZIONI DALLA NATURA

Per rivelare la struttura tridimensionale a livello molecolare, sono necessari i cristalli, ma quando si ha a che fare con i ribosomi, ci sono ulteriori sfide. Il ribosoma è un complesso di proteine e catene di RNA; la sua struttura è straordinariamente intricata; è insolitamente flessibile, instabile e privo di simmetria interna, il che ne rendeva la cristallizzazione un compito estremamente formidabile.
All’inizio degli anni ’80, lavorando sia al Weizmann Institute in Israele che al Max Planck Institute in Germania, la dottoressa Yonath riuscì a creare i primi microcristalli di ribosomi. La procedura, che sviluppò appositamente per questo scopo, includeva un metodo proprio per la preparazione del ribosoma cristallizzabile.
alla ricerca di ribosomi

L’ispirazione venne da un articolo sugli orsi in letargo che impacchettano i loro ribosomi in modo ordinato nelle loro cellule poco prima del letargo, e questi rimangono intatti e potenzialmente funzionanti per mesi.
Partendo dal presupposto che questa è una strategia naturale per mantenere a lungo l’attività ribosomiale, ella cercò ribosomi da organismi che vivono in condizioni difficili, in primo luogo semi termofili, forniti dal dr. V. Erdmann e più tardi sviluppò un sistema sperimentale unico basato su ribosomi presi dai batteri resistenti che vivono negli ambienti estremi del Mar Morto, sorgenti termali e pile atomiche. In questo modo riuscì a produrre i primi microcristalli di ribosoma in un tempo abbastanza breve. Ma venne sbeffeggiata da una buonaparte del mondo accademico ufficiale.
NUOVE TECNOLOGIE PER LA DETERMINAZIONE DELLA STRUTTURA RIBOSOMIALE

A metà degli anni ’80 del novecento, la dottoressa Yonath riuscì a visualizzato un tunnel che attraversa la grande subunità ribosomiale e ipotizzato, sulla base di precedenti lavori biochimici (Malkin & Rich, 1967, Blobel & Sabatini, 1970) che questo è il percorso attraverso il quale la proteina nascente progredisce mentre viene formata – finché non emerge dal ribosoma.
Nel corso della sua ricerca, ella sviluppò una serie di nuove tecniche che sono oggi ampiamente utilizzate nei laboratori di biologia strutturale di tutto il mondo. Uno di questi è la crio-bio-cristallografia, che consiste nell’esporre il cristallo a temperature estremamente basse, –185°C, per ridurre al minimo la disintegrazione della struttura cristallina sotto il bombardamento di raggi X.
A metà degli anni ’90, una volta dimostrata la fattibilità della cristallografia dei ribosomi, diversi gruppi di importanti università o istituti di ricerca avviarono sforzi paralleli.
risoluzione del problema
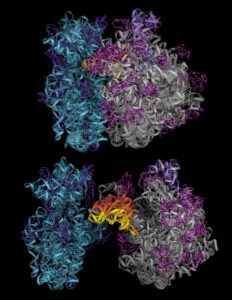
Poiché potevano ripetere le sue procedure, Ada non era più sola in questo campo.
Alla fine degli anni ’90, il gruppo di lavoro della dottoressa Yonath e coloro che aveva utilizzato i suoi sistemi sperimentali riuscirono a rompere la barriera della risoluzione del problema, grazie ai miglioramenti nei cristalli, nelle strutture per rilevare la diffrazione dei raggi X e nei modi per determinare le fasi di diffrazione.
La prima mappa della densità elettronica della piccola subunità del ribosoma fu una vera svolta. Poi, nel 2000 e nel 2001, furono pubblicati i lavori sulle prime strutture tridimensionali complete di entrambe le subunità del ribosoma batterico.
Ada Yonath è riuscita a mappare l’intera complessa molecola ribosomiale, composta da centinaia di migliaia di atomi, un’impresa considerata da molti impossibile.
fonti e riferimenti:
- https://en.wikipedia.org/wiki/X-ray_crystallography
- https://it.wikipedia.org/wiki/Cristallo
- https://it.wikipedia.org/wiki/Cristallografia
- https://www.nobelprize.org/uploads/2018/06/yonath-lecture-slides.pdf
- JOANNIS KEPLERI S. C. MAJEST. MATHEMATICI “STRENA SEU DE NIVE SEXANGULA“, 1611
- https://www.nobelprize.org/prizes/physics/1914/summary/
- https://it.wikipedia.org/wiki/Max_von_Laue
- https://www.nobelprize.org/prizes/physics/1915/summary/
- https://it.wikipedia.org/wiki/William_Henry_Bragg
- https://www.adelaide.edu.au/library/special/stories/bragg/
- https://it.wikipedia.org/wiki/William_Lawrence_Bragg
- https://www.nobelprize.org/prizes/physics/1915/wl-bragg/facts/
- https://macromoltek.medium.com/what-is-x-ray-crystallography-1e186bc3d180
- “The structure of some crystals as indicated by their diffraction of X-rays“, di William Lawrence Bragg (Published: 22 September 1913)
- DOROTHY CROWFOOT HODGKIN: “The X-ray analysis of complicated molecules“, Nobel Lecture, December 11, 1964
- “From X-rays to Biomolecular Structure: D. Hodgkin, R. Franklin and A. Yonath“, di Gonçalves-Maia, R. [Rev. Virtual Quim., 2012, 4 (6), 818-839. Data de publicação na Web: 26 de outubro de 2012]
- “Configurazione molecolare nel timonucleato di sodio” (1953), di Rosalind Franklin e Raymond Gosling; Di: Victoria Hernández (Pubblicato: 2019-11-30)
- https://en.wikipedia.org/wiki/John_Kendrew
- https://www.nobelprize.org/prizes/chemistry/1962/kendrew/biographical/
- JOHN C . KENDREW: “Myoglobin and the structure of proteins“; Nobel Lecture, December 11, 1962
- https://en.wikipedia.org/wiki/Max_Perutz
- MAX F . PERUTZ: “X-ray analysis of haemoglobin“; Nobel Lecture, December 11, 1962
- “La cristallografia conta, eccome!“
- https://www.nobelprize.org/prizes/chemistry/2009/yonath/biographical/