HAIDAR FRANGOUL L’EMATOLOGO – ONCOLOGO CHE HA UTILIZZATO L’EDITING GENETICO CRISPR-Cas9 NEL PRIMO STUDIO CLINICO SU UNA PAZIENTE AFFETTA DA ANEMIA FALCIFORME

Nel mese di luglio del 2019, Haydar Frangoul, Direttore del “Sarah Cannon Pediatric Haematology/Oncology and Cellular Therapy” presso il “TriStar Centennial Medical Center” di Nashville, Tennesseee, U.S.A., ha fatto la storia clinica dell’editing genomico somministrando, per la prima volta, cellule autologhe modificate geneticamente con CRISPR-Cas9 ad una donna afroamericana, Victoria Gray, di 33 anni del Mississippi, affetta da anemia falciforme.
Alla paziente era stata diagnosticata l’anemia falciforme sin da bambina, il che la costringeva a lunghe degenze ospedaliere e a stanchezza debilitante ma in particolar modo all’assunzione di continuo di potenti antidolorifici, Dopo diversi anni, prende in considerazione l’ eventualità di trapianto di midollo osseo ma poi sentendo parlare della terapia genica CRISPR – Cas9 ex vivo, coglie al volo questa opportunità presentandosi come volontaria al Centro diretto da Frangoul per essere sottoposta a questo trattamento sperimentale autologo, uno degli esperimenti medici più attesi degli ultimi decenni.
UN NUOVO TRATTAMENTO

Nello specifico, il nuovo trattamento sponsorizzato da Vertex Pharmaceuticals, prevedeva l’estrazione di cellule staminali ematopoietiche dal midollo osseo della paziente. Successivamente l’isolamento in laboratorio e l’utilizzo del correttore genomico CRISPR-Cas9 per modificare le cellule staminali emopoietiche autologhe e per produrre livelli elevati di Emoglobina fetale (HbF) nei globuli rossi, ha inattivato il gene BCL11A, l’interruttore che spegne la produzione di emoglobina fetale dopo la nascita, compensando, in questo modo, la mutazione nel gene della Beta globina (Adenina al posto di una Timina) che aveva causato la malattia.
L’HbF, ora prodotta, è in grado di trasportare l’ossigeno e di rimpiazzare così la forma adulta di emoglobina, di cui i pazienti affetti da anemia falciforme sono privi, e il suo aumento ha il potenziale per ridurre la necessità di trasfusioni per i pazienti con talassemia e diminuire le crisi dolorose e debilitanti in quelli con anemia falciforme.
somministrazione di CTX001
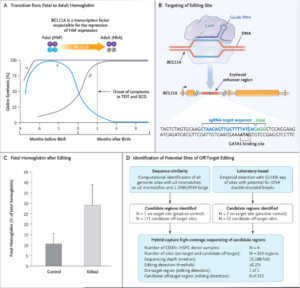
Lo studio di Frangoul e coll., pubblicato il 21 gennaio 2021 sul New England Journal of Medicine, descriveva i primi due pazienti, una donna di 19 anni con TDT (β-talassemia trasfusione-dipendente) ed una donna di 33 anni con SCD (anemia falciforme), che sono state infuse con CTX001 (CRISPR-Cas9 autologo modificato CD34 + HSPC geneticamente modificato per riattivare la produzione di emoglobina fetale) e arruolati in CLIMB THAL- 111 (per il paziente con TDT) e CLIMB SCD-121 (per il paziente con SCD).
I risultati del processo ottenuti da Frangoul e coll. hanno generato grande entusiasmo aprendo una strada che appare in discesa per il trattamento per il trattamento dell’anemia falciforme e che prevedrà il passaggio da trattamenti ex vivo costosi e difficili ad un approccio in vivo che sembra funzionare in altri contesti, in particolare, nel fegato.
Bibliografia:
- Frangoul H, Altshuler D, Cappellini M. Domenica, et al.(2021) “CRISPR-Cas9 gene editing for sickle cell disease and b-thalassemia” . N Engl J Med 384 : 252 – 260
- https://www.tristarmedgroup.com/physicians/profile/Dr-Haydar-A-Frangoul-MD
- https://nashvillelifestyles.com/people/top-doctors/top-doctors-haydar-frangoul/
Articolo del prof. Sergio Barocci