A Karikó e Weissman il Premio Nobel per la Medicina 2023
“Il DNA e l’RNA stimolano il sistema immunitario innato dei mammiferi attraverso l’attivazione dei receptors Toll-like (recettori Toll-simili, TLR). Il DNA contenente motivi CpG (oligodeossinucleotidi CpG, ndr) metilati, tuttavia, non è stimolante.
Anche i nucleosidi selezionati nell’RNA naturale vengono metilati o altrimenti modificati, ma gli effetti immunomodulatori di queste alterazioni rimangono non testati. Mostriamo che l’RNA segnala attraverso TLR3, TLR7 e TLR8 umani, ma l’incorporazione di nucleosidi modificati m5C, m6A, m5U, s2U o pseudouridina abla l’attività.
Le cellule dendritiche (DC) esposte a tale RNA modificato esprimono significativamente meno citochine e marcatori di attivazione rispetto a quelle trattate con RNA non modificato. Le DC e le cellule che esprimono TLR sono potentemente attivate dall’RNA batterico e mitocondriale, ma non dall’RNA totale dei mammiferi, che è abbondante in nucleosidi modificati.
Concludiamo che le modifiche nucleosidiche sopprimono il potenziale dell’RNA di attivare le DC. Il sistema immunitario innato può quindi rilevare l’RNA privo di modificazione nucleosidica come mezzo per rispondere selettivamente ai batteri o al tessuto necrotico”.
[Katalin Karikó, Michael Buckstein, Houping Ni e Drew Weissmann; 2005]
NOBEL PER LA MEDICINA 2023
 Come da prassi, il primo lunedì di ottobre viene assegnato il Nobel per la Medicina e Fisiologia.
Come da prassi, il primo lunedì di ottobre viene assegnato il Nobel per la Medicina e Fisiologia.
Quest’anno il premio è stato riconosciuto alla biochimica Katalin Karikó ed all’immunologo Drew Weissman, con la menzione ‘per le loro scoperte sulle modifiche delle basi nucleosidiche che hanno consentito lo sviluppo di vaccini mRNA efficaci contro il COVID-19‘.
Anche questa volta la notizia non mi coglie impreparato e, non a caso, i due scienziati avevano ricevuto nel 2021 il prestigioso (Clinacal) ‘Lasker Award‘, che abbiamo capito essere un’anticamera del riconoscimento concesso dall’Accademia Svedese delle Scienze.
Katalin Karikó & Drew Weissman

Katalin Karikó (nata nel 1955) è una biochimica ungherese, specializzata in meccanismi mediati dall’RNA.
Nel 1997, lo statunitense Drew Weissman (nato nel 1959) si trasferì all’Università della Pennsylvania per avviare il suo laboratorio per studiare l’RNA e la biologia del sistema immunitario innato.
Fu in questa Università che lui e Katalin Karikó scoprirono, brevettarono e pubblicarono le modifiche all’RNA necessarie per renderlo praticabile come terapia.
Nel 2005, I due ricercatori sono riusciti, modificando un nucleoside, a creare un M-RNA ibrido che poteva intrufolarsi nelle cellule senza allertare le difese del corpo.
TLR E NUCLEOSIDI
I recettori Toll-simili (TLR) sono una classe di proteine che svolgono un ruolo chiave nel sistema immunitario innato. Sono recettori a passaggio singolo che attraversano la membrana solitamente espressi su cellule sentinella come macrofagi e cellule dendritiche, che riconoscono molecole strutturalmente conservate derivate da microbi. Una volta che questi microbi hanno raggiunto le barriere fisiche come la pelle o la mucosa del tratto intestinale, vengono riconosciuti dai TLR, che attivano le risposte delle cellule immunitarie.
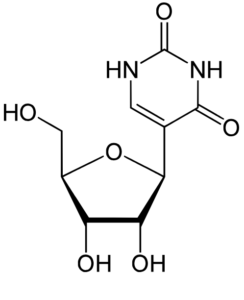
I nucleosidi sono composti chimici costituiti da uno zucchero pentoso e da una base azotata purinica (adenina, guanina) o pirimidinica (citosina, uracile, timina) unite per mezzo di un legame β-glicosidico.
un nucleoside non immunogenico
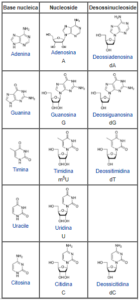 I nucleosidi si possono ottenere semplicemente per idrolisi dagli acidi nucleici: infatti i nucleosidi, per aggiunta di un gruppo fosfato, formano i nucleotidi, i monomeri dell’RNA o del DNA a seconda che lo zucchero costituente sia rispettivamente il ribosio o il desossiribosio.
I nucleosidi si possono ottenere semplicemente per idrolisi dagli acidi nucleici: infatti i nucleosidi, per aggiunta di un gruppo fosfato, formano i nucleotidi, i monomeri dell’RNA o del DNA a seconda che lo zucchero costituente sia rispettivamente il ribosio o il desossiribosio.
Il sistema immunitario innato è la prima linea di difesa contro gli agenti patogeni invasori. Questo sistema utilizza i TLR per riconoscere modelli molecolari associati ai patogeni conservati ed orchestrare l’avvio delle risposte immunitarie. Diversi TLR riconoscono e rispondono agli acidi nucleici.
Per anni, il DNA batterico e quello dei mammiferi sono stati descritti come aventi la stessa struttura chimica, il che ha ostacolato la comprensione del motivo per cui solo il DNA batterico, ma non quello dei mammiferi, è immunogenico.
DNA BATTERICO E DEI MAMMIFERI
Successivamente, alla fine degli anni novanta del novecento, si è cominciata ad apprezzare la sequenza e la microeterogeneità strutturale del DNA. Si scoprì che l’RNA ribosomiale (rRNA), l’85% dell’RNA cellulare, contiene significativamente più modifiche nucleosidiche quando ottenuto da cellule di mammifero rispetto a batteri. L’rRNA umano, ad esempio, ha dieci volte più pseudouridina (Ψ) e 25 volte più nucleosidi 2′-O-metilati dell’rRNA batterico. La presenza di nucleosidi modificati era stata stata dimostrata anche nelle regioni interne di molti RNA virali tra cui influenza, adeno e herpes simplex.
Considerando che le cellule solitamente contengono da cinque a dieci volte più RNA che DNA, la presenza di tali caratteristiche distintive sull’RNA le rendeva e una ricca fonte molecolare per il campionamento da parte del sistema immunitario, un concetto che diventava evidente con l’identificazione di più TLR che segnalano in risposta all’RNA.
RNA IMMUNOGENICO E NON
 La Karikò e Weissman studiarono l’effetto immunomodulatore dell’RNA sulle cellule dendritiche umane. Questi studi hanno dimostravano che l’RNA trascritto in vitro attiva e fa maturare le cellule dendritiche (Weissman et al., 2000) parzialmente mediante un meccanismo in cui le regioni a doppio filamento dell’RNA segnalano attraverso TLR-3 (Kariko et al., 2004). l’RNA totale derivato da batteri, ma non da cellule eucariotiche, possono innescare le cellule per la secrezione di Interleuchina-12 (IL-12) ad alti livelli (Koski et al., 2004).
La Karikò e Weissman studiarono l’effetto immunomodulatore dell’RNA sulle cellule dendritiche umane. Questi studi hanno dimostravano che l’RNA trascritto in vitro attiva e fa maturare le cellule dendritiche (Weissman et al., 2000) parzialmente mediante un meccanismo in cui le regioni a doppio filamento dell’RNA segnalano attraverso TLR-3 (Kariko et al., 2004). l’RNA totale derivato da batteri, ma non da cellule eucariotiche, possono innescare le cellule per la secrezione di Interleuchina-12 (IL-12) ad alti livelli (Koski et al., 2004).
Nei primi anni del nuovo secolo venne studiato il potenziale immunostimolante di diversi sottotipi di RNA cellulare. I due colleghi oggi ‘nobelizzati’ determinarono che l’RNA e l’mRNA totali, nucleari e citoplasmatici dei mammiferi inducono tutti la secrezione di TNF-α, (Il fattore di necrosi tumorale α, solitamente abbreviato come TNFα, dall’inglese Tumor necrosis factor, è una citochina coinvolta nell’infiammazione sistemica) sebbene a livelli molto bassi rispetto all’RNA sintetizzato in vitro dalla T7 RNA polimerasi (RNAP). Inoltre, il tRNA dei mammiferi non aveva indotto alcun livello rilevabile di TNF-α, mentre l’RNA mitocondriale era il tipo di RNA più potente per stimolare gli MDDC (monocyte-derived dendritic cells).
INCORPORAZIONE DELLA PSEUDO-URIDINA NELLA STRUTTURA DELL’RNA
Essi riuscirono anche a dimostrare che incorporando alcuni nucleotidi nell’RNA si poteva ridurre la loro immunogenicità, ossia la capacità di attivare le cellule dendritichce, eseguendo reazioni di trascrizione in vitro in cui uno o due dei quattro nucleotidi trifosfati (NTP) erano stati sostituiti con un corrispondente NTP modificato con nucleosidi.
Nel loro studio del 2005, Karikò, Weissman e coll. affermavano:
“È interessante notare che solo le modifiche dell’uridina, come m5U, s2U o Ψ, ma non m5C o m6A, potrebbero abolire la capacità dell’RNA di attivare le cellule dendritiche primarie derivate dal sangue”.
concludendo
In questo modo, come avvenuto per i vaccini ad m-RNA contro il Covid, si è creata la possibilità di immettere negli organismi vivente dell’RNA che potesse indurre la produzione di specifiche proteine senza attivare la risposta immunitaria degli stessi organismi.
RIFERIMENTI:
- “Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA“, by Katalin Karikó, Michael Buckstein, Houping Ni, Drew Weissman [Immunity. 2005 Aug;23(2):165-75]
- https://www.nobelprize.org/prizes/medicine/2023/summary/
- https://en.wikipedia.org/wiki/Toll-like_receptor
- https://twitter.com/NobelPrize/status/1708780262883017166
- https://en.wikipedia.org/wiki/CpG_oligodeoxynucleotide
- https://en.wikipedia.org/wiki/Drew_Weissman
- https://en.wikipedia.org/wiki/Katalin_Karik%C3%B3
- https://en.wikipedia.org/wiki/Toll-like_receptor
- https://twitter.com/NobelPrize/status/1708781081422414139
- https://it.wikipedia.org/wiki/Nucleoside