I percorsi storici che hanno portato alla scoperta del sistema Rh
- Articolo del prof. Sergio Barocci
“Questo report tratta di una proprietà rara nel sangue di una paziente il cui siero mostrava un’iso-agglutinina di attività moderata, che agglutinava circa l’80% del sangue del suo stesso gruppo. In considerazione del fatto che questa agglutinina tendeva a scomparire dopo un intervallo di diversi mesi e del fatto che questa agglutinina dava una reazione altrettanto forte a 37° e 20°, sembrerebbe assomigliare alle agglutinine risultanti dall’isoimmunizzazione in seguito a ripetute trasfusioni.
Questo fenomeno è facilmente riprodotto in alcune specie (bovini, polli, conigli), mediante numerose trasfusioni ripetute, ma nel caso dell’uomo sono descritti in letteratura solo due casi netti di tale isoimmunizzazione ad elementi cellulari. Il caso che descriveremo differisce da questi in quanto l’isoagglutinina immunitaria deve essere stata stimolata da un fattore diverso dalla trasfusione ripetuta.”
Philip Levine, M.D. & Rufus E. Stetson, M.D., 8 luglio 1939.
La scoperta del sistema Rh

Nel 1901, Karl Landsteiner, attraverso una serie di semplici, ma geniali esperimenti scoprì che cimentando campioni di globuli rossi e siero di soggetti diversi si osservava una reazione di aggregazione (agglutinazione), ovvero una reazione immunologica determinata dalla presenza nel siero di un soggetto di anticorpi contro gli antigeni degli eritrociti appartenenti ad un altro individuo.
Attraverso questo lavoro, egli rese possibile la determinazione del sistema sanguigno AB0 individuando la presenza di quattro diversi gruppi sanguigni che denominò rispettivamente A, B, AB e 0, rivoluzionando la credenza diffusa a quei tempi in base alla quale il sangue era ritenuto identico in tutti gli individui e ponendo così le basi per il suo corretto utilizzo nella pratica trasfusionale.
SISTEMA AB0 E SISTEMA RH

Per tale scoperta, K. Landsteiner ricevette il Premio Nobel per la Medicina nel 1930.
Diversi anni dopo la scoperta del sistema AB0, ci si rese conto che tale sistema gruppo-ematico non era tuttavia l’unico ad avere un importante impatto per le trasfusioni di sangue, ma che esisteva anche un altro sistema, chiamato “Rh”. La sua importanza era determinata dal fatto che, essendo fortemente immunogeno, era in grado di stimolare la comparsa di anticorpi responsabili di potenziali forti reazioni emolitiche trasfusionali.
Il fattore Rh fu scoperto tra gli anni 1939-1940, dopo il sistema AB0 e i sottogruppi A1, A2 etc. Ancora oggi, l’attribuzione della sua scoperta è controversa poiché gli studi in quel periodo furono molti e pubblicati contemporaneamente. Tuttavia, un grande merito, almeno inizialmente, lo ebbero Philip Levine e Rufus E. Stetson nel 1939, sebbene l’importanza clinica dei loro studi non fu subito evidente.
malattia emolitica del neonato

Essi ipotizzarono una possibile relazione clinica tra la reazione emolitica trasfusionale (dovuta al non riconoscimento di un fattore che sarà poi scoperto essere quello Rh) e la “malattia emolitica del neonato” (MEN) nella sua forma più grave, pubblicando il caso enigmatico di una donna di 25 anni durante una gestazione.
Dopo aver dato alla luce il bambino morto, la donna fu trasfusa ed ebbe gravi reazioni nonostante il sangue provenisse dal marito e fosse in apparenza compatibile (Gruppo 0) con il suo per quanto riguardava gli antigeni del sistema AB0.
Le ricerche che seguirono portarono alla scoperta di un fatto nuovo: il siero della donna agglutinava, specie se tenuto alla temperatura di 37°C, i globuli rossi del marito e di altri 80 individui su 104 di gruppo 0. Appariva evidente che il determinante antigenico responsabile della reazione trasfusionale era indipendente dai determinanti antigenici conosciuti sino a quel momento.
un fattore sensibilizzante il sangue

I due immunoematologi ipotizzarono che qualche fattore sconosciuto, proveniente dal sangue del primo bambino, fosse venuto a contatto con il sangue della madre e l’avesse “sensibilizzata“, determinando sia la reazione al sangue del marito che la perdita del secondo figlio. Successivamente essi dimostrarono che:
a) la donna si era immunizzata verso un antigene fetale ereditato dal marito;
b) l’anticorpo trovato nel siero della donna doveva aver attraversato la placenta e prodotto la distruzione o lisi dei globuli rossi e la morte del secondo figlio;
c) lo stesso anticorpo doveva essere responsabile della potente reazione trasfusionale emolitica che aveva avuto la donna.
Tali evidenze cliniche non ebbero importanti ripercussioni sino al 1940, anno in cui Karl Landsteiner e Alexander S. Wiener scoprirono sui globuli rossi di una specie di primati il “Macacus Rhesus” un nuovo antigene denominato “fattore Rh” (dal nome del primate).
Anticorpi che agglutinano eritrociti umani e di macaco

Tale scoperta avvenne iniettando sperimentalmente a conigli e a porcellini d’India (cavia domestica) globuli rossi della scimmia Macacus Rhesus (oggi designata Macacus Mulatta).
Essi ottennero un siero di coniglio contenente anticorpi che agglutinavano sia le emazie di scimmia che gli eritrociti dell’85% della popolazione umana. Risultava chiaramente che tali anticorpi rivelavano la presenza di un determinante antigenico diverso e indipendente da quelli del sistema AB0.
Alexander S. Wiener ed Harold R. Peters nello stesso anno dimostrarono che alcuni individui trasfusi con sangue AB0 compatibile, che avevano avuto reazione trasfusionale, presentavano nel loro sangue un anticorpo che si comportava esattamente come l’anti-Rh del coniglio. Fu quindi dimostrata l’importanza trasfusionale dell’antigene Rh (D secondo la nomenclatura di Fisher) responsabile non solo di numerosi incidenti trasfusionali ma anche della maggior parte dei casi di “malattia emolitica neonatale” o “eritroblastosi fetale”.
Rh+ & Rh-

Apparvero subito evidenti le somiglianze fra il siero della donna studiata da Levine ed il siero di coniglio anti-Rhesus. Esisteva infatti una sovrapposizione del comportamento immunologico dei due sieri e di conseguenza anche la specificità del siero umano venne indicata come anti-Rh ed Rh il determinante antigenico corrispondente.
In base a questi criteri e a seconda della sua presenza, fu possibile differenziare gli individui in due gruppi: Rhesus positivi o Rh+ (che reagivano con l’anticorpo anti-Rh) e Rhesus negativi o Rh- (i cui globuli rossi non si legavano all’anti-Rh). L’espressione Rh- stava ad indicare l’assenza del determinante antigenico Rh sulla membrana dei globuli rossi.
Nel 1941 P. Levine e E. M. Katzin revisionando diversi casi di eritroblastosi fetale compresero che questa malattia era dovuta ad un processo di immunizzazione materna nei riguardi di qualche antigene fetale che nella maggioranza dei casi era rappresentato dal primo antigene Rh noto ed unico per quel periodo.
ANTICORPI SIMILI MA NON IDENTICI

Più tardi, nel 1942 e più chiaramente nel 1963, si comprese che l’anticorpo anti-Rhesus prodotto nel coniglio dagli esperimenti di Landsteiner e Wiener era in realtà strettamente correlato a quello prodotto nell’uomo, ma non identico. Tuttavia, anche se il termine di “Rh” o “Rhesus” riferito ai globuli rossi umani non è esatto, la sua denominazione rimane di uso corrente.
Verso la metà degli anni ’40, si incominciò a notare che non tutti gli anticorpi anti-Rh erano identici, in quanto alcuni soggetti agglutinavano i globuli rossi di una percentuale minore di individui e che il fattore Rh era solo uno degli antigeni in un sistema che si presentava ben più complesso di quanto lasciassero prevedere le prime esperienze.
Infatti, poco dopo la scoperta dell’anti-Rh, studi familiari dimostrarono che l’Antigene Rh (D) era geneticamente determinato e la via di trasmissione del carattere seguiva quella di un carattere autosomico dominante.
IL SISTEMA RH

Dapprima P. Levine nel 1941 e successivamente Arthur Mourant nel 1945, individuarono in pazienti immunizzati dapprima la presenza di anticorpi che evidenziavano chiaramente l’esistenza di determinanti antigenici diversi ai quali Ronald Aylmer Fisher e Robert Russell Race dettero i simboli di D, C, E, c, e, tra loro correlati che segregavano insieme e che potevano appartenere ad uno stesso sistema gruppo ematico che venne chiamato Sistema Rh. Studi effettuati su famiglie infatti, dimostrarono che l’Antigene Rh (D) era geneticamente determinato e la via di trasmissione del carattere seguiva quella di un carattere autosomico dominante
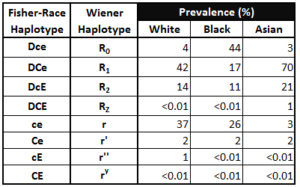
A questo punto erano quindi noti cinque antigeni del sistema Rh rispettivamente D, C, c, E, e, e, dal momento che gli anticorpi anti-C e anti-c, anti-E e anti-e davano reazioni antitetiche, si ipotizzò che fossero il prodotto di geni allelici e che, per analogia, si sarebbe dovuta verificare l’esistenza di un altro anticorpo d che potesse identificare l’antigene antitetico di D ma questo anticorpo non è stato mai trovato a tutt’oggi.
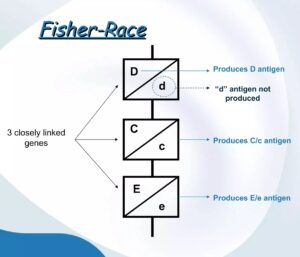
Tre geni codominanti
Con questi dati Ronald Fisher sviluppò un’ipotesi genetica che prevedeva l’esistenza di tre geni codominanti cioè esprimenti il proprio carattere anche allo stato eterozigote strettamente associati sul cromosoma 1.
L’unica eccezione era data dall’allele “d” che non esprimendo alcun carattere doveva essere completamente dominato da D. Ogni gene poteva esistere in due forme alleliche alternative: C oppure c; D oppure d; E oppure e. Si venivano così a formare otto possibili combinazioni che in ordine di frequenza erano: CDe, cde, cDE, cDe, Cde, cdE, CDE, CdE.
DIVERSA FREQUENZA DEGLI APLOTIPI

Ognuna di queste combinazioni costituisce un complesso genetico o “aplotipo” (combinazione di varianti alleliche lungo un cromosoma o segmento cromosomico contenente loci in linkage disequilibrium, cioè strettamente associati tra di loro e che in genere vengono ereditati insieme) inseparabile sul cromosoma e come tale trasmesso alla prole.
R. Fisher cercò anche di spiegare la diversa frequenza degli aplotipi, ammettendo che durante l’evoluzione erano avvenuti occasionali crossing-over (meccanismo di ricombinazione del materiale genetico proveniente dai due genitori, che permette una maggiore varietà nei prodotti della riproduzione sessuata). Tale meccanismo riguarda lo scambio di porzioni omologhe di materiale genetico, che si verifica fra due cromatidi appartenenti a due cromosomi diversi di una coppia di omologhi. Questo scambio è facilitato dall’allineamento dei cromosomi omologhi.
UN SISTEMA COMPLESSO
Dai complessi originali (cromosomi di 1° ordine) sarebbero derivati i quattro complessi cDe, Cde, cdE e CDE (cromosomi di 2° ordine). Ad esempio, per spiegare il complesso genico CdE è necessario ammettere un avvenuto crossing-over tra i complessi cromosomici cDE e Cde e ciò spiegherebbe la rarità di CdE.
In seguito, furono scoperti molti altri antigeni correlati al sistema Rh e molti di questi antigeni presentano differenze sia qualitative che quantitative. Sebbene il numero degli antigeni sia cospicuo, i 5 antigeni principali D, C, c, E, e ed i loro rispettivi anticorpi costituiscono la maggior parte delle problematiche cliniche che coinvolgono questo sistema complesso.
Benché gli antigeni del sistema Rh siano pienamente espressi alla nascita e rilevabili anche all’ 8° mese di gestazione, essi sono solo presenti sui globuli rossi, mentre non sono riscontrabili sulle piastrine e su altre cellule come i linfociti, monociti, neutrofili o su altre cellule tissutali.
PROSEGUE (CLICCA)
BIBLIOGRAFIA:
- Landsteiner, K., & Wiener, A. (1940) “An agglutinable factor in human blood recognized by immune sera for rhesus blood“. Proceedings of the Society for Experimental Biology and Medicine, 43, 223 – 224.
- Landsteiner, K., & Wiener, A. (1941). “Studies on an agglutinogen (Rh) in human blood reacting with anti-Rhesus sera and with human antibodies“. Journal of Experimental Medicine, 74, 309-320.
- Levine, P., & Stetson, R. (1939). “An unusual case of intra-group agglutination“. Journal of the American Medical Association, 113,426-427.
- PHILIP LEVINE, P. VOGEL, E. M. KATZIN, AND L. BURNHAM: “Pathogenesis of Erythroblastosis Fetalis: Statistical Evidence“, SCIENCE 17 Oct 1941, Vol 94, Issue 2442, pp. 371-372
- Rosenfield, R., Allen, F., Swisher, S., & Kochwa, S. (1979). “Rh nomenclature“. Transfusion, 4, 487.
- Tippet, P. (1986). “A spectulative model for the Rh blood groups“. Annals of Human Genetics, 50, 241- 247
Sitografia e Riferimenti:
- https://www.google.it
- https://en.wikipedia.org/wiki/Philip_Levine_(physician)
- https://laskerfoundation.org/winners/rh-factor-as-a-cause-of-hemolytic-anemia-in-newborns/
- https://www.rockefeller.edu/our-scientists/philip-levine/2365-albert-lasker-award/
- https://it.wikipedia.org/wiki/Fattore_Rh#Storia
- https://en.wikipedia.org/wiki/Rh_blood_group_system#History
- https://hekint.org/2019/12/31/the-rh-factor-an-intertwined-history/
- “Rh Blood Group System“, di Daniel Rosenkrans; Muhammad Zubair; Alexander Doyal. Last Update: August 2, 2023.
- https://en.wikipedia.org/wiki/Alexander_S._Wiener
- https://en.wikipedia.org/wiki/Hemolytic_disease_of_the_newborn
- “Alloimmunisation fœto-maternelle Rhésus grave à propos d’un cas et revue de la littérature” di Benkerroum Zineb, Lachiri Boutaina, Lazrak Ikram, Moussaoui Rahali Driss, Dehayni Mohammed; PAMJ (Volume 22, Article 137, 14 Oct 2015)
- https://www.slideshare.net/zahoor061/rh-blood-group-system