Breve storia di Adalimumab
 Adalimumab (nome commerciale Humira), il farmaco più remunerativo del 2013, è un anticorpo monoclonale “umanizzato” con azione antinfiammatoria, inibitore del TNF (Tumor Necrosis Factor).
Adalimumab (nome commerciale Humira), il farmaco più remunerativo del 2013, è un anticorpo monoclonale “umanizzato” con azione antinfiammatoria, inibitore del TNF (Tumor Necrosis Factor).
Il farmaco, venduto dalla compagnia americana AbbVie (azienda scorporata dalla Abbott Laboratories), è stato scoperto grazie ricerca collaborativa di “BASF Bioresearch Corporation” (Worcester, Massachusetts, una unità of BASF) e “Cambridge Antibody Technology“, che è iniziata nel 1993.
UN ARTICORPO MONOCLONALE
 Adalimumab è stato il primo anticorpo monoclonale completamente ‘umano’ approvato dalla Food and Drug Administration (FDA) statunitense. È stato derivato dal “display fagico”. I risultati preliminari dei primi trials clinici risalgono al 1999.
Adalimumab è stato il primo anticorpo monoclonale completamente ‘umano’ approvato dalla Food and Drug Administration (FDA) statunitense. È stato derivato dal “display fagico”. I risultati preliminari dei primi trials clinici risalgono al 1999.
L’efficacia e la sicurezza dell’anticorpo (in fase di studio chiamato D2E7) è stata valutata in numerosi esperimenti. La capacità di D2E7 di neutralizzare la bioattività del TNF è stata dimostrata in tre differenti sistemi cellulari in vitro.
Successivamente, la capacità di combattere le poliartiti è stata mostrata in topi transgenici che “mimano” la progressione istopatologia dell’Artrite Reumatoide negli umani.
un antinfiammatorio
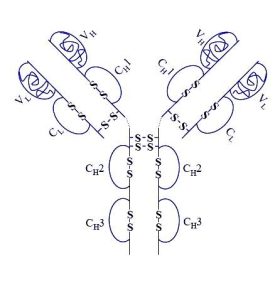
Adalimumab è un farmaco usato per trattare l’artrite reumatoide, l’artrite psoriasica, la spondilite anchilosante, il morbo di Crohn, la colite ulcerosa, la psoriasi, l’idradenite suppurativa, l’uveite e l’artrite idiopatica giovanile.
L’ uso è generalmente raccomandato solo nelle persone che non hanno risposto ad altri trattamenti. Viene somministrato per iniezione sottocutanea.
Adalimumab è stato approvato per uso medico negli Stati Uniti nel 2002. È nell’elenco dei medicinali essenziali dell’Organizzazione Mondiale della Sanità. È disponibile come farmaco biosimilare. Nel 2019 è stato il 152° farmaco più comunemente prescritto negli Stati Uniti, con oltre 4 milioni di prescrizioni.
RIFERIMENTI:
- https://www.facebook.com/SullaFisiologia/photos/a.1431901567052521/1434747430101268/
- “Preliminary results of early clinical trials with the fully human anti-TNFα monoclonal antibody D2E7“, DI Dr J Kempeni (Ann Rheum Dis 1999;58:(Suppl I) I70–I72)
- https://en.wikipedia.org/wiki/Adalimumab#History
- https://www.abbottinvestor.com/news-releases/news-release-details/abbott-laboratories-investigational-fully-human-anti-tnf-therapy
- “Phage display-derived human antibodies in clinical development and therapy“, di Andrè Frenzel, Thomas Schirrmann e Michael Hust (MABS 2016, VOL. 8, NO. 7, 1177–1194)