I vincitori del Lasker~DeBakey Clinical Medical Research Award 2019: gli inventori del Trastuzumab
Per la loro invenzione di Herceptin, il primo anticorpo monoclonale che blocca una proteina cancerogena, e per il suo sviluppo come terapia salvavita per le donne con carcinoma mammario.
 Il premio “Lasker ~ DeBakey Clinical Medical Research Award 2019” rende omaggio a tre scienziati, lo statunitense H. Michael Shepard, l’oncologo statunitense Dennis Slamon (nato nel 1948) ed il tedesco Axel Ullrich (nato nel 1943) che inventarono Herceptin (principio attivo trastuzumab), il primo anticorpo monoclonale che blocca una proteina cancerogena, e lo trasformarono in una terapia salvavita per le donne affette da carcinoma mammario. L’innovazione riduce il rischio di recidiva e prolunga i tempi di sopravvivenza per i pazienti con malattia metastatica e allo stadio iniziale.
Il premio “Lasker ~ DeBakey Clinical Medical Research Award 2019” rende omaggio a tre scienziati, lo statunitense H. Michael Shepard, l’oncologo statunitense Dennis Slamon (nato nel 1948) ed il tedesco Axel Ullrich (nato nel 1943) che inventarono Herceptin (principio attivo trastuzumab), il primo anticorpo monoclonale che blocca una proteina cancerogena, e lo trasformarono in una terapia salvavita per le donne affette da carcinoma mammario. L’innovazione riduce il rischio di recidiva e prolunga i tempi di sopravvivenza per i pazienti con malattia metastatica e allo stadio iniziale.
Herceptin, una risorsa nella lotta al cancro mammario
Ogni anno, ad oltre 50.000 donne negli Stati Uniti viene diagnosticato il tipo di tumore al seno che il farmaco attacca e oltre 2,3 milioni di persone hanno ricevuto il trattamento da quando trastuzumab è diventato disponibile. Shepard (ora al BetterOutcomes4Cancer) e Ullrich (ora al Max Planck Institute of Biochemistry, Martinsried, Germania) hanno condotto le loro indagini su Herceptin lavorando alla compagnia farmaceutica Genentech. Slamon ha svolto le sue presso l’Università della California, a Los Angeles (UCLA), dove continua a lavorare.
A metà degli anni settanta del novecento, gli scienziati hanno scoperto che i geni all’interno del nostro stesso corpo possono scatenare il cancro (oncogeni).
geni e cancro, una storia recente

Questa rivelazione ha scatenato l’idea che soffocare le attività di tali oncogeni poteva contrastare i problemi che essi determinano. Questo approccio – in cui una farmaco si sarebbe fissato a delle molecole che risiedono specificamente nelle cellule tumorali conducendone anche alla malignità – ha suscitato un grande fascino. Una strategia così mirata avrebbe potuto evitare molti dei duri effetti collaterali associati alla chemioterapia mentre colpisce la fonte dell’afflizione.
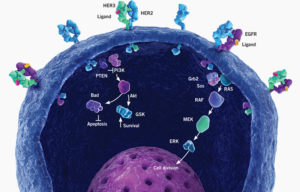
Gli scienziati della Genentech realizzarono una raccolta di anticorpi monoclonali nei topi e ne analizzarono in modo particolare uno che inibiva la crescita di diverse linee cellulari di carcinoma mammario. Esso mostrava questo effetto solo sulle linee cellulari che producono in eccesso la proteina HER2.
HER2
Ma cos’è HER2? Nel 1985, Ullrich, Arthur Levinson (anche lui di Genentech) e colleghi trovarono un gene la cui sequenza ricorda quella del recettore del fattore di crescita epidermico umano (EGFR o HER1) e l’oncogene di pollo v-erbB. Lo chiamarono HER2 – recettore EGF umano 2 – per questa somiglianza. La sua sequenza e posizione sul cromosoma suggerisce che poteva essere la versione umana di neu, un oncogene di ratto scoperto l’anno prima da Robert Weinberg (Massachusetts Institute of Technology). Indipendentemente e contemporaneamente, altri due gruppi, guidati da Stuart Aaronson (National Cancer Institute) e Tadashi Yamamoto (Università di Tokyo), identificarono l’HER2 e mostrarono che era amplificato in tumori maligni sia in quello del seno che della ghiandola salivare umana.
cercando di bersagliare tessuti tumorali

Nel frattempo, l’oncologo della UCLA Slamon e, indipendentemente, il defunto William McGuire (University of Texas Medical Center, San Antonio), stavano raccogliendo tessuti tumorali che erano stati rimossi chirurgicamente per motivi terapeutici e controllando se gli oncogeni accertati stavano “sparando” eccessivamente in essi. Ullrich, con il suo gene “allettante“, e Slamon, con la sua biblioteca di tumori umani, si unirono. Nel 1987, essi riportarono che quasi il 30% di 189 campioni di carcinoma mammario conteneva più di una copia del gene HER2. L’analisi delle cartelle cliniche per molti delle pazienti rappresentate nello studio ha rivelato che le donne i cui tumori erano portatori di più copie del gene ricadevano più rapidamente nella malattia e morivano prima di quelle che avevano una sola copia. Inoltre, l’amplificazione genetica prediceva meglio la prognosi rispetto alla maggior parte degli indicatori standard, come la dimensione del tumore e lo stato del recettore ormonale.
STUDIANDO AL LABORATORIO CELLULE IN COLTURE
Per indagare su questo problema (relazione causale tra sovrabbondanza di HER2 e malignità tumorale), Ullrich e il collega Robert Hudziak congegnarono delle cellule del tessuto connettivo del topo coltivate in colture da laboratorio per produrre proteine HER2 extra. La HER2 supplementare faceva sì che le cellule continuassero a dividersi in condizioni in cui di solito si fermavano, un segno di trasformazione verso uno stato canceroso. Le cellule potenziate con HER2 mostravano anche altre prove di malignità e formavano tumori dopo l’iniezione nei topi. Poiché l’unica differenza tra le “cellule corrotte” e “cellule educate” era la quantità di HER2, questi risultati indicavano che il recettore del fattore di crescita in eccesso sblocca le normali restrizioni sulla replicazione.
Contemporaneamente e in parallelo, Shepard, nel suo laboratorio alla Genentech, era arrivato a HER2 da una direzione diversa. Stava indagando sui meccanismi con cui le cellule tumorali sfuggono alla distruzione da una sostanza chimica chiamata fattore di necrosi tumorale-α (TNF-α), un componente della risposta immunitaria del corpo. Aveva scoperto che l’attivazione di alcune tirosin chinasi può frenare la potenza letale del TNF-α. Insieme, lui e Ullrich dimostrarono che HER2 rende le cellule del topo resistenti agli effetti tossici del TNF-α.
HER2 PROMUOVE TUMORI AGGRESSIVI?
Forse, hanno ragionato, l’HER2 promuove i tumori aggressivi non solo provocando un rallentamento della crescita, ma anche rafforzando le cellule e dotandole di modi per resistere agli assalti che normalmente li ucciderebbero. Se quantità eccessive di HER2 causano crescita in fuga e protezione dal sistema di difesa del corpo, la funzione del recettore di annullamento potrebbe invertire questi comportamenti aberranti. La parte della proteina che risiede al di fuori della cellula era particolarmente affascinante perché era probabilmente accessibile a un farmaco. Per bloccare la stimolazione HER2, i ricercatori volevano sviluppare un composto che si legasse a questa porzione esposta e impedisse i segnali in arrivo. Essi cercarono anticorpi monoclonali per questo scopo.
Un anticorpo selettivo

Gli scienziati di Genentech realizzarono una collezione di anticorpi monoclonali nei topi ed in particolar modo ne analizzarono uno che inibiva la crescita di diverse linee cellulari di carcinoma mammario. Fondamentalmente, esso aveva questo effetto solo sulle linee cellulari che producevano in eccesso la proteina HER2. Inoltre, esso sensibilizzava queste cellule tumorali all’uccisione di TNF-α. Questo anticorpo, soprannominato 4D5, non si legava al parente di HER2, il recettore EGF umano, una caratteristica importante, poiché un farmaco di successo non deve interferire con le attività delle cellule sane. Queste osservazioni suggerivano che un trattamento a base di 4D5 avrebbe distrutto solo le cellule che sovraesprimono l’HER2.
ESITAZIONI ALLA GENENTECH
Nonostante questi risultati favorevoli, l’esitazione si nascondeva tra coloro che dovevano prendere decisioni alla Genentech. Molti esperti erano scettici sul fatto che gli anticorpi monoclonali si sarebbero rivelati terapeuticamente utili contro il cancro, specialmente per le neoplasie solide piuttosto che ematiche, anche perché gli scienziati dubitavano che questi agenti riuscissero a penetrare nei tumori. Per rafforzare la ricerca clinica, Shepard e Slamon condussero numerosi studi. Essi mostrarono, ad esempio, che l’anticorpo murino radioattivamente marcato si accumulava nei tumori, ma solo in quelli delle donne con tumori che producono HER2 in eccesso. Questa osservazione diede energia al team, così come la volontà dei pazienti di partecipare agli studi anche se non avrebbero ricevuto benefici clinici e avrebbero potuto avere conseguenze sconosciute. Tale generosità si è ripetuta in numerosi passaggi dell’impresa.
alla fine un successo clinico
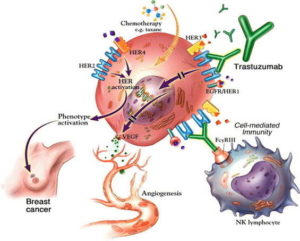
Durante questo periodo, i ricercatori raccolsero anche dati che avrebbero aiutato a guidare la spiegazione clinica del potenziale farmaco. Utilizzando cellule di carcinoma mammario umano coltivate in laboratorio, Slamon e colleghi esplorarono il modo migliore di combinare l’anticorpo con i regimi della chemioterapia standard. Gli scienziati di Genentech e Slamon svilupparono anche test diagnostici per identificare le donne con tumori al seno con iperespressione di HER2 (HER2 +).
Nel 1998, i dati erano abbastanza forti che l’anticorpo monoclonale umanizzato – ora chiamato trastuzumab (marchio commerciale, Herceptin) – ottenne l’approvazione da parte della Food and Drug Administration (FDA) negli Stati Uniti.
L’approvazione della fda
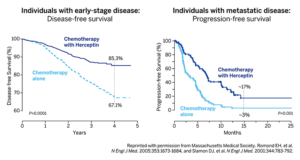
Nel 2001, Slamon e colleghi pubblicarono i loro risultati. Un ampio studio randomizzato su donne con carcinoma mammario HER2 + progressivo aveva rivelato che l’aggiunta di Herceptin alla chemioterapia bloccava la progressione della malattia, riduceva il tasso di mortalità di un anno dal 33% al 22% ed estendeva la sopravvivenza globale. In successivi studi sullo stadio precoce, il carcinoma mammario HER2 + dimostrò che Herceptin migliora anche i risultati in tale contesto, per il quale è stato approvato dalla FDA nel 2006 (vedere la figura).
vedi:
- http://www.laskerfoundation.org/awards/show/herceptin-targeted-antibody-therapy-breast-cancer/
- https://www.cell.com/cell/pdf/S0092-8674(19)30946-8.pdf