CHARLOTTE FRIEND, una grande della virologia del novecento

Nel 1956, ad un meeting dell’Americ Association for Cancer Research (AACR) ad Atlantic City, Charlotte Friend riferì sull’isolamento di un virus che produceva una leucemia fatale quando veniva inoculato in topi adulti.1
Questo era un momento in cui il concetto di virus che provoca il cancro era ancora visto con estremo scetticismo e la presentazione di tali dati da parte di un’attraente giovane donna che era appena uscita dalla scuola di specializzazione fu accolta con incredulità e derisione.2
CONTRO LO SCETTICISMO

Gli argomenti del pubblico contro le sue scoperte erano essenzialmente gli stessi di quelli che Peyton Rous aveva sentito nei primi anni del novecento quando descrisse un tumore di pollo che era inducibile da un agente trasmissibile. I detrattori sostenevano, da un lato, che l’agente isolato non era un virus perché induceva una malattia maligna e, dall’altro, che la malattia non poteva essere un tumore maligno perché era un virus. Tuttavia, la rapida conferma delle scoperte di Friend da parte rispettatissimo patologo Jacob Furth portò a un cambiamento negli atteggiamenti, e la comunità scientifica presto si rese conto che un virus che induce rapidamente una malattia maligna nei topi adulti fornisce un modello eccellente in cui studiare sia il virus in oncologia e la patogenesi della neoplasia. Il virus di Friend è diventato il principale sistema di ricerca sulla leucemogenesi virale e oggi si riconosce che tutti coloro che lavorano sui virus tumorali abbiano a che fare con i contributi di Charlotte Friend.3
L’INFANZIA DI Charlotte friend

Charlotte Friend nacque nel 1921 a New York, in Houston Street, nella Lower Manhattan, da genitori immigrati dalla Russia. Sua madre aveva studiato farmacista, ma rinunciò a qualsiasi ambizione professionale per crescere la famiglia. Il padre, un uomo d’affari di successo, morì quando lei aveva tre anni e sua madre trasferì la famiglia di quattro figli nel Bronx per essere vicina e avere il sostegno di altri parenti. L’eredità sostanziale lasciata dal padre di Friend fu dissipata nel disastro finanziario del 1929, e il fatto che la famiglia avesse dovuto accettare “i soccorsi” dalla città per sopravvivere ebbe un effetto duraturo su Friend. Ella ha sempre ammirato sua madre per aver potuto mantenere la famiglia insieme durante questo periodo e per non lasciare mai che i bambini dubitassero che avrebbero completato la loro istruzione. Mentre cresceva, Charlotte approfittò di tutte le opportunità offerte da New York. Diventò una grande appassionata di tutte le sue attività culturali e partecipò con successo all’ammissione alla Hunter College High School, una parte dell’eccellente sistema educativo della città per studenti di talento. Dopo aver terminato la scuola superiore, frequentò l’Hunter College di notte mentre lavorava nell’ufficio di un medico durante il giorno.
LA LAUREA

Dopo essersi laureata nel 1943, Friend si arruolò nella Marina degli Stati Uniti e fu assegnata alla Midshipmen’s School dello Smith College di cui divenne alfiere nell’aprile del 1944. Fu presto promossa a tenente e nominata comandante in seconda del laboratorio di ematologia dell’Ospedale navale di Shoemaker, California. Fin dalla prima infanzia aveva pensato di diventare uno scienziato, ma questa era la sua prima vera esperienza di lavoro in un laboratorio e ciò la convinse che questo era quanto voleva davvero fare nella sua vita.
Quando la guerra finì, Friend ebbe il sostegno finanziario del “G.I. Bill of Rights” per continuare la sua formazione. Prese in considerazione l’idea di frequentare la facoltà di Medicina, ma scelse invece di iscriversi come studente universitario presso il Dipartimento di Microbiologia dell’Università di Yale.
LA CARRIERA

Friend aveva già apprezzato l’importanza del consiglio e l’aiuto di scienziati di spicco per le sue ricerche, e durante i fine settimana si recava spesso a New York per consultare gli eminenti immunologi Elvin Kabat e Michael Heidelberger alla Columbia. Ella ricevette un dottorato di ricerca dalla Yale nel 1950 con una tesi sugli effetti del salicilato di sodio (aspirina) sulle reazioni antigene-anticorpo.
Friend fu assunta da Cornelius P. Rhoads, il direttore di quello che allora era il nuovo “Sloan-Kettering Institute for Cancer Research” di Boston, per lavorare nel laboratorio dei virus di Alice E. Moore. Rhoads era un individuo molto dinamico ed entusiasta, che era estremamente solidale con i membri del suo Istituto, e lui e Friend svilupparono un forte rispetto reciproco e ammirazione. Allo Sloan-Kettering, Friend incontrò Cecily Cannan Selby, fresca di recente dottorato del Massachusetts Institute of Technology, che era interessata alla struttura cellulare.
L’INIZIO DI UN’IMPORTANTE COLLABORAZIONE

Ciò accadeva agli albori della microscopia elettronica e, quando Selby trovò un microscopio nell’Istituto che non era in uso, lei e Friend decisero di esaminare la struttura fine delle cellule del “carcinoma ascite di Ehrlich”, un tumore trapiantabile nei topi che a quel tempo era un modello comunemente usato per la ricerca sul cancro. Selby e Friend osservarono inaspettatamente citoplasmatiche “particelle di diametro costante in serie ravvicinata” che erano simili a quelle osservate nelle sezioni sottili di cellule infettate da virus, 4 e Friend cercò quindi di determinare se queste particelle fossero biologicamente attive. Friend inoculò estratti cellulari delle cellule di ascite in topi appena nati, seguendo una procedura per la trasmissione di un virus della leucemia murino che Ludwik Gross aveva introdotto alcuni anni prima.5 I topi rimasero in salute per un periodo di osservazione di quattordici mesi, ma, quando quando furono sacrificati e sottoposti ad autopsia, a sei topi venne riscontrato un ingrossamento del fegato e delle milze.
I TOPI DI FRIEND

Friend avrebbe potuto rimanere sorpresa o sgomenta nel vedere quella che sembrava essere la leucemia quando aveva inoculato un estratto di cellule di carcinoma, ma era abbastanza intelligente e abbastanza curiosa da seguire l’osservazione. Poiché i topi neonati non erano disponibili, iniettava sospensioni cellulari dalla milza ingrandita in topi adulti e, nel giro di pochi mesi, molti avevano la milza palpabile. Con il terzo passaggio di sospensioni cellulari o filtrati di estratti cellulari, un’alta percentuale di topi sviluppava leucemia con un periodo di latenza di solo due o tre settimane. La malattia che Friend stava vedendo era molto diversa dal linfoma indotto dal virus di Gross: era caratterizzata da eritroblastosi e anemia profonda; era trasmissibile in topi “noninbred” adulti; e il periodo di latenza prima che apparissero i primi sintomi era molto breve, dato che quest’ultima era una prova evidente che l’agente trasmissibile era direttamente coinvolto nell’induzione della leucemia.
il virus di friend
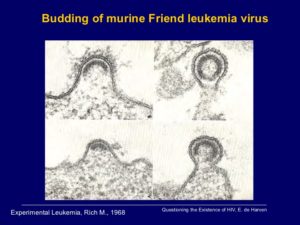 È interessante notare che le particelle citoplasmatiche originariamente osservate da Selby e Friend 4 erano molto diverse per dimensioni e struttura da quello che alla fine si dimostrò essere l’agente eziologico della leucemia di Friend. In studi di microscopia elettronica molto eleganti condotti con Etienne deHarven, Friend ha scoperto che il suo agente era un virus di tipo C (6) che successivamente è stato classificato, sulla base della struttura genomica, come un retrovirus (virus RNA contenente trascrittasi inversa). Friend e deHarven furono tra i primi a descrivere il ciclo vitale di questi virus a forma di ciambella che ‘germogliano’, un termine suggerito dal loro tecnico, a causa della superficie cellulare delle cellule leucemiche.
È interessante notare che le particelle citoplasmatiche originariamente osservate da Selby e Friend 4 erano molto diverse per dimensioni e struttura da quello che alla fine si dimostrò essere l’agente eziologico della leucemia di Friend. In studi di microscopia elettronica molto eleganti condotti con Etienne deHarven, Friend ha scoperto che il suo agente era un virus di tipo C (6) che successivamente è stato classificato, sulla base della struttura genomica, come un retrovirus (virus RNA contenente trascrittasi inversa). Friend e deHarven furono tra i primi a descrivere il ciclo vitale di questi virus a forma di ciambella che ‘germogliano’, un termine suggerito dal loro tecnico, a causa della superficie cellulare delle cellule leucemiche.
la presentazione del virus
Charlotte Friend non ha mai dimenticato il modo in cui lei e il suo nuovo virus della leucemia sono stati accolti al meeting del 1956 dalla A.A.C.R. Quelli che erano presenti ricordano la dignità e il coraggio con cui ha risposto alla raffica di domande. Lei stessa descrisse il procedimento magnificamente e dettagliatamente nel suo “Indirizzo Presidenziale” alla stessa società vent’anni dopo.2 Disse che, nonostante gli avvertimenti sulle obiezioni che le sarebbero state sollevate, “in nessuna parte dell’immaginazione poteva anticipare la violenta tempesta di polemiche che sarebbe esplose dopo la sua presentazione“. Si chiedeva come mai il suo amico che presiedette la sessione non usasse la richiesta di Rous di “tenere le menti aperte” come un’opportunità per raffreddare l’atmosfera surriscaldata e finalmente concludere la sessione. È un segno del suo carattere il fatto che non abbia mai rivelato l’identità di quel presidente nel suo “discorso di indirizzo presidenziale” e che essi sono sempre rimasti cari amici.
un carattere timido?

Ella era orgogliosa di essere “uscita in maniera limpida anche se un pò ferita” (2) da quell’esperienza e più tardi fu in grado di scherzare sul fatto che coloro che persistevano nelle loro credenze eretiche sui virus tumorali venivano accusati di avere “buchi nella testa o buchi nei loro filtri“. Tuttavia, potrebbe essere che a causa di questa esperienza piuttosto traumatica, non sia mai diventata una persona forte e fiduciosa. Durante la sua carriera, ogni volta che doveva tenere un discorso, era sempre molto nervosa e passava molto tempo e fatica a scrivere esattamente quello che voleva dire.
Come co-editore del Journal of Experimental Medicine e un forte sostenitore, Rous ha lavorato con Friend nella stesura e nella redazione della prima pubblicazione integrale che descrive il nuovo virus.7 Egli diede molti suggerimenti riguardo alla documentazione, i dettagli e la presentazione, che lui credeva di essere “in grado di risolvere tutti i dubbi relativi a un virus che causa la leucemia nei topi“. La pubblicazione risultante fornì le informazioni necessarie alla comunità scientifica per accettare il virus e per riconoscerne le potenzialità come un ‘modello di sistema ideale’ su cui lavorare.
La natura neoplastica della malattia indotta è stata successivamente confermata dalla dimostrazione che i tumori solidi trapiantabili potevano essere ottenuti con tessuti leucemici da topi infettati da virus. La leucemia era originariamente descritta come non chiaramente granulocitica o monocitica e richiedeva un’ampia sperimentazione da parte di Friend (8) e altri per dimostrare che l’obiettivo primario per la trasformazione maligna era, in realtà, un precursore eritroide. Si ritiene ora che lo sviluppo della malattia coinvolga almeno due eventi: una stimolazione precoce dell’eritropoiesi seguita da un evento clonale che si traduce in cellule di eritroleucemia immortali e trapiantabili.
In seguito alla scoperta dei virus da parte di Gross e Friend, sono stati isolati numerosi altri virus a RNA che hanno indotto la leucemia nei topi e in altre specie. Ciò che in origine era ritenuto impossibile, si è trasformato in riconoscimenti e Friend ha iniziato ad essere onorata per il suo lavoro. Nel 1962 ha ricevuto il premio Alfred P. Sloan per la ricerca sul cancro e ha scelto di usare i soldi per viaggiare in tutto il mondo, trascorrendo periodi di tre mesi in Istituti di ricerca in Francia, Israele e Australia lavorando con scienziati come Andre Lwoff, Leo Sachs e Donald Metcalf. Ella ha scritto che il viaggio è stata una delle esperienze più importanti della sua vita, dal momento che uno dei suoi sogni più grandi era quello di lavorare all’Istituto Pasteur.
FRIEND LEKEMIA VIRUS
Nonostante tutto il lavoro che è stato fatto su ‘Friend Lekemia Virus‘ (FLV), sappiamo ancora molto poco sui meccanismi molecolari con cui si replica e si trasforma. Sappiamo che questi meccanismi sono estremamente complessi, quindi forse non sorprende che negli anni ci siano stati disaccordi e controversie riguardo a vari aspetti del virus e della malattia indotta. Il virus originale isolato ha prodotto una leucemia associata ad anemia ma con la sua distribuzione ad altri laboratori e il passaggio dall’ospite all’ospite, sono comparsi ceppi virali che hanno prodotto la policitemia piuttosto che l’anemia. Questi ceppi hanno causato la formazione di focolai macroscopici di primitive cellule eritroidi sulla superficie della milza che apparivano prima dell’epatosplenomegalia e potevano essere quantificati. Questi sono stati dimostrati come dovuti alla presenza in preparati di ceppi che inducono policitemia di un virus difettoso formante focolai splenici (SFFV) che era competente per la trasformazione cellulare ma non per la replicazione virale. Alcuni ricercatori hanno riferito che solo i ceppi policitemici del Friend Virus hanno indotto la leucemia nei topi adulti e che il ceppo anemico era efficace solo nei neonati. È stato suggerito che, contrariamente a quanto inizialmente riportato da Friend, è stato richiesto più di un virus per la patogenesi della leucemia (vedi le recensioni di Friend e Pogo 9 e Ostertag et al.10).
Friend ha sempre resistito a quell’idea. Forse la fredda accoglienza che lei e il virus avevano ricevuto in origine l’avevano sensibilizzata a ciò che lei poteva considerare una critica a quel primo lavoro e al suo potere di osservazione. Sostenne che nelle sue mani, anche dopo vent’anni di continuo passaggio, il ceppo anemico originario di FLV (FLV-A, quello che lei chiamava virus di tipo selvatico o prototipo), la sua gamma di ospiti, il periodo di latenza e la dipendenza dell’età, e la sindrome che quel virus indusse non era diversa da ciò che aveva riferito per la prima volta.
Ella ha insistito sul fatto che FLV-A non conteneva un componente difettoso di formazione focale splenico 11 e che era diverso dai ceppi virali con cui altri potrebbero aver lavorato successivamente. La sua amica Frank Lilly una volta “cercò di convincerla che avrebbe dovuto essere orgogliosa di aver scoperto non solo uno, ma in realtà due virus che erano totalmente unici nel mondo dei virus della leucemia dei topi. Ma lei sostenne che non avrebbe avuto nulla a che fare con quell’idea.” 12 E, in effetti, altri hanno dimostrato che il FLV-A clonato molecolarmente, senza alcun componente SFFV, induce una forma anemica di una malattia eritroproliferativa nei topi neonati che assomiglia alle prime fasi della malattia indotta dal virus wild-type. (13) Tuttavia, nessuno ha ancora spiegato il meccanismo mediante il quale l’anemia profonda indotta da tale virus nei neonati o negli adulti progredisce verso la leucemia.
La maggior parte dei virologi ha preso la posizione secondo cui il Friend Virus è un complesso composto da un SFFV difettoso che dipende dalla replicazione del FLV competente per la per la sua stessa replicazione e che entrambi i virus sono necessari per la produzione di leucemia fatale nei topi adulti. Charlotte Friend ha sempre riconosciuto che durante il passaggio in vivo, le varianti virali potevano essere originate dalla ricombinazione con elementi cellulari o virus endogeni e non era sorpresa che un agente come SFFV fosse stato trovato in alcuni stock di virus. Tuttavia, voleva capire cosa accadeva negli altri laboratori, discutere le varie possibilità con altri scienziati e analizzare le storie di passaggio dei vari ceppi virali. Studiosi come Arthur Axelrad e Frank Lilly che hanno avuto la pazienza di tali discussioni le sono rimasti buoni amici per tutta la vita. Altri che volevano andare avanti e non essere eccessivamente preoccupati di ciò che sarebbe potuto accadere al virus negli anni persero ogni contatto con lei e, sfortunatamente, forse persero anche il rispetto per lei e per i suoi risultati.
la carriera di friend
Rhoads, il direttore dello Sloan-Kettering, era morto nel 1959 e la successiva amministrazione era molto più strutturata di quanto non fosse stata sua. Friend non aveva il rapporto affettuoso con il nuovo direttore come quello che aveva avuto con Rhoads e non pensava di ottenere il riconoscimento che meritava. Quindi, accetto subito la proposta di unirsi ad una nuova scuola medica organizzata al Mt. Sinai Hospital di New York. Nel 1966 accettò il posto di professoressa e direttrice del “Center for Experimental Cell Biology“. Ella richiese e ricevette la promessa che non avrebbe avuto responsabilità didattiche. Voleva essere libera di fare ciò che faceva meglio e più apprezzava: la ricerca. Il nuovo laboratorio era di dimensioni ed amenità piuttosto modesti e un’entità scientifica di base in qualche modo piuttosto isolata. Nella sua nuova posizione, Friend era responsabile di raccogliere essenzialmente tutto il denaro necessario per il personale, le forniture, le attrezzature e i servizi di supporto. Divenne strettamente legata al sistema di sussidi federali per le principali esigenze del centro che dirigeva, e nei suoi ultimi anni divenne un onere enorme che interferì con il suo piacere di fare ricerca.
un altro importante contributo scientifico
Fu al Monte Sinai che Friend diede un altro contributo scientifico fondamentale quando dimostrò che le cellule tumorali possono essere indotte a differenziarsi da un agente esogeno e, quindi, perdere la loro capacità di moltiplicarsi. Lei aveva precedentemente osservato che le cellule dei tumori solidi prodotti dal trapianto di tessuto leucemico da topi inoculati del virus Friend non mostravano elementi eritroidici riconoscibili, ma che la natura eritroide delle cellule poteva essere dimostrata in determinate condizioni. Ad esempio, Friend e Cecilia Patuleia erano state in grado di costruire linee cellulari permanenti in coltura dalle cellule tumorali e di dimostrare che, anche se clonate, queste colture consistevano in cellule indifferenziate e una piccola percentuale di cellule in vari stadi della maturazione eritroide. 14, 15.
La loro osservazione che queste cellule maligne erano, in effetti, in grado di subire la maturazione fu accolta con incredulità da alcuni colleghi, anche se le prove avrebbero dovuto essere incontrovertibili dalle loro diapositive e fotografie. “Come possono le cellule tumorali che sono state in coltura per 6 mesi dare origine a eritroblasti?” chiesero. “Ci deve essere un contaminante.” Ma di nuovo di fronte allo scetticismo, Friend persisteva, sapendo che il suo sistema cellulare forniva un superbo “modello per lo studio della leucemia come una malattia risultante da un difetto di maturazione“. 16 Lei iniziò ad esplorare la possibilità che il blocco di differenziazione nelle cellule leucemiche poteva essere rimosso.
Ciò la condusse alla scoperta che le cellule dell’erythroleukemia di Friend (FELC) in coltura potevano essere ulteriormente stimolate alla differenziazione lungo il percorso eritroide mediante l’aggiunta del dimetil solfossido (DMSO) al solvente.17 Io ho usato il DMSO come solvente per composti idrofobici in colture cellulari. Mi ricordo un giorno una sua telefonata in cui mi chiese quale concentrazione usare per un esperimento che voleva provare. Qualche giorno dopo mi richiamò, piena di eccitazione per il fatto che le sue cellule fossero “pinkies, tutti rosa, tutti rosa”. Il suo associato, Bill Scher, ricorda anche che correva su e giù per il corridoio trattenendo il tubo con la pallottola di cellule rosa che tutti potevano vedere. Lei continuò dimostrando che, con alcune linee cellulari di eritroleucemia altamente inducibili, la percentuale di cellule positive alla benzidina (produzione di emoglobina) poteva essere aumentata fino a oltre l’85%, da un basale dell’1%, dopo quattro-cinque giorni in mezzo contenente DMSO. Friend ha chiaramente e drammaticamente dimostrato che l’espressione del fenotipo maligno poteva essere invertita sperimentalmente.
La sua osservazione fu rapidamente riprodotta e confermata in altri laboratori e presto divenne evidente che le alterazioni morfologiche e biochimiche che seguirono l’induzione della differenziazione erano simili a quelle che si verificano nella normale eritropoiesi. Le cellule di Friend sono diventate un modello ampiamente utilizzato per studiare il controllo della sintesi dell’emoglobina e per analizzare la regolazione generale dell’espressione genica nella proliferazione e differenziazione cellulare.
Questa nuova scoperta ha portato ad un altro entusiasmante periodo di riconoscimenti per Friend. Essa fu eletta alla Hunter College Hall of Fame e ha ricevuto lo “Yale Science and Engineering Association Award“. Venne onorata con la medaglia Dameshek, il Prix Griffuel e il premio Papanicolaou. Nel 1976 le fu riconosciuto il massimo riconoscimento dai suoi colleghi, essendo stata eletta alla National Academy of Sciences.
Alla fine degli anni ’60 un giovane patologo italiano, Giovanni Rossi, trascorse diversi anni lavorando nel laboratorio di Friend. Divennero stretti colleghi scientifici e amici devoti e nel 1977, quando ebbe l’opportunità di passare un anno sabbatico all’estero, andò a Roma dove si era stabilito Rossi. Lei si divertì moltissimo lavorando al Laboratorio Nazionale del Consiglio Nazionale delle Ricerche, di cui Rita Levi-Montalcini era il direttore. Le due donne avevano un grande rispetto reciproco e quando Friend lasciò Roma, la professoressa Levi-Montalcini le diede un’incisione intitolata “La spirale di Archimede“, fatta dalla sorella gemella, Paola.
la malattia
Charlotte Friend apprese per la prima volta di avere il linfoma nel suo sessantesimo compleanno nel 1981. Comunicò la notizia a pochissime persone in modo che gli altri lo sapessero. Sebbene si sottopose ad una terapia estensiva e debilitante, lei continuò a trascorrere il suo tempo in laboratorio, a scrivere, a partecipare a riunioni ed a discutere di lavoro con le altre persone, a inviare manoscritti ed a presentare proposte e, quando necessario, a discutere con redattori, revisori e amministratori. Fece tutto il possibile per mantenere a galla il suo laboratorio, sempre con la speranza di perpetuare il suo lavoro. Per lei tutto quello che succedeva nel suo laboratorio era sempre in cima ai suoi pensieri. Aveva preferito fare le cose da sola e non trasformare i progetti in altri. E così, non aveva mai creato un gruppo attivo di giovani investigatori che studiavano i problemi di suo interesse. Alla fine, non era rimasto nessuno per mantenere il centro e continuare il suo lavoro.
Una delle ultime apparizioni pubbliche di Charlotte Friend è stata alla Brandeis University, dove ha ricevuto un dottorato honoris causa nel maggio 1986. Era molto orgogliosa di essere stata selezionata per questo onore e lasciò il suo letto d’ospedale per fare il viaggio a Waltham, nel Massachusetts. Friend partecipò alla manifestazione su una sedia a rotelle e, nonostante un sole cocente, rimase per tutta la lunga cerimonia. Morì otto mesi dopo, il 13 gennaio 1987.
chi fu charlotte friend?
All’apice della sua carriera, Charlotte Friend fu forse uno dei più noti e benvoluti biologi cellulari ed oncologi. Era una persona molto solare e socievole, anche se un po timida. Aveva un buon senso dell’umorismo e un modo piuttosto affascinante di interagire con le persone. Era estremamente generosa quando si trattava di distribuire il suo virus (FLV) e le sue cellule (FELC) a coloro che volevano lavorarci, e avrebbe dato a quegli investigatori tutta la guida e l’assistenza di cui avevano bisogno per il loro lavoro. Molti ricordano con piacere le visite al suo laboratorio, gli incontri a pranzo e le discussioni su quello che stavano facendo o avrebbero fatto con gli strumenti meravigliosi che lei aveva fornito. E se venivano da fuori città, si assicurava sempre che fossero adeguatamente trattati.
Il suo appartamento nel complesso di Stuyvesant Town sulla East 14th Street venne conosciuto come “The Friend Hotel“, per amici e colleghi vicini e lontani invitati a rimanere lì quando erano in visita New York – e lo facevano spesso, alcuni per settimane ogni volta. Charlotte Friend nutriva una vera preoccupazione per le persone e si interessava alle loro vite personali, alle loro famiglie e ai loro problemi. Era sempre disponibile ad ascoltare e spesso trascorreva serate in laboratorio o a casa. Lei aveva uno staff dedicato che l’avrebbe seguita fino ai confini della terra. Diversi, come il patologo Jamil Haddad e il tecnico J. Gilbert Holland, hanno lavorato con lei per oltre trenta anni.
- traduzione di un articolo di Leila Diamond (Memorie Biografiche, 1994, cap. 6, Charlotte Friend)
Bibliografia:
- C. Friend, “The Isolation of a Virus Causing a Malignant Disease of the Hematopoietic System in Adult Swiss Mice,” Proc. Am. Assoc. Cancer Res.2(1956):106.
- C. Friend, “Presidential Address: The Coming of Age of Tumor Virology,” Cancer Res. 37(1977):1255–63
- L. Diamond and S. R. Wolman, eds., “Viral Oncogenesis and Cell Differentiation: The Contributions of Charlotte Friend.” (Ann. N.Y. Acad. Sci.567, 1989).
- C. C. Selby, C. E. Grey, S. Lichtenberg, C. Friend, A. Moore, and J. J. Biesele, “Submicroscopic Particles Occasionally Found in the Ehrlich Mouse Ascites Tumor,” Cancer Res. 14(1954):790–94.
- L. Gross, “Pathogenic Properties, and ‘Vertical’ Transmission of the Mouse Leukemia Agent,” Proc. Soc. Exp. Biol. Med. 78(1951):342–48.
- E. deHarven and C. Friend, “Electron Microscope Study of a Cell-Free Induced Leukemia of the Mouse: A Preliminary Report.” J. Biophys. Biochem. Cytol. 4(1958):151–56.
- C. Friend, “Cell-Free Transmission in Adult Swiss Mice of a Disease Having the Character of a Leukemia,” J. Exp. Med. 105(1957):307–18
- G. B. Rossi and C. Friend, “Erythrocytic Maturation of (Friend) Virus-induced Leukemic Cells in Spleen Clones,” Proc. Natl. Acad. Sci. USA58(1967):1373–80.
- C. Friend and B. G.-T. Pogo, “The Molecular Pathology of Friend Erythroleukemia Virus Strains: An Overview,” Biochim. Biophys. Acta.780(1985):181–95.
- W. Ostertag, C. Stocking, G. R. Johnson, N. Kluge, R. Kollek, T. Franz, and N. Hess, “Transforming Genes and Target Cells of Murine Spleen Focus-Forming Viruses.” Adv. Cancer Res. 48(1987):193–355.
- E. H. Brown, M. Zajac-Kaye, B. G.-T. Pogo, and C. Friend, “Rat Cells Infected with Anemia-Inducing Friend Leukemia Virus Contain Integrated Replication-Competent But Not Defective Proviral Genomes,” Proc. Natl. Acad. Sci. USA 82(1985):5925–29.
- F. Lilly, “Leukemia, Viruses, Development and the Real World,” in: Viral Oncogenesis and Cell Differentiation: The Contributions of Charlotte Friend, eds. L. Diamond and S. R. Wolman (Ann. N.Y. Acad. Sci. 567:274–77, 1989).
- A. I. Oliff, G. L. Hager, E. H. Change, E. M. Scolnick, H. W. Chan, and D. R. Lowry, “Transfection of Molecularly Cloned Friend Murine Leukemia Virus DNA Yields Highly Leukemogenic Helper-Independent Type C Virus,” J. Virol. 33(1980):475–86.
- C. Friend, M. C. Patuleia, and E. deHarven, “Erythrocyte Maturation in Vitro of Murine (Friend) Virus-Induced Leukemic Cells,” Natl. Cancer Inst. Monogr. 22(1966):505–22.
- M. C. Patuleia and C. Friend, “Tissue Culture Studies on Murine Virus-Induced Leukemia Cells: Isolation of Single Cells in Agar-Liquid Medium,” Cancer Res. 27(1967):726–30.
- C. Friend, “The Phenomenon of Differentiation in Murine Erythroleukemic Cells,” The Harvey Lectures (New York: Academic Press, 1979):253–87.
- C. Friend, W. Scher, J. G. Holland, and T. Sato, “Hemoglobin Synthesis in Murine Virus-Induced Leukemic Cells In Vitro: Stimulation of Erythroid Differentiation by Dimethyl Sulfoxide,” Proc. Natl. Acad. Sci. USA 68(1971): 378–82.